Empfindliches Wärmekonzept, Formeln und Übungen gelöst

- 2120
- 548
- Ivan Pressler
Er Empfindliche Wärme Es ist die thermische Energie, die einem Objekt zugeführt wird, wodurch seine Temperatur zunimmt. Es ist das Gegenteil von latenter Wärme, bei der die thermische Energie die Temperatur nicht erhöht, sondern eine Phasenänderung fördert, beispielsweise von fest zu flüssig.
Ein Beispiel verdeutlicht das Konzept. Angenommen, wir haben einen Topf mit Wassertemperatur von 20 ° C. Wenn wir es in das Horn legen, erhöht die gelieferte Wärme die Wassertemperatur langsam auf 100 ° C (Siedetemperatur des Wassers auf Meereshöhe). Die gelieferte Wärme wird als empfindliche Wärme bezeichnet.
 Die Wärme, die Ihre Hände erwärmt, ist empfindliche Wärme. Quelle: Pixabay
Die Wärme, die Ihre Hände erwärmt, ist empfindliche Wärme. Quelle: Pixabay Sobald das Wasser die Kochtemperatur erreicht hat, erhöht die vom Hornilla gelieferte Wärme die Wassertemperatur, die bei 100 ° C bleibt. In diesem Fall wird die gelieferte thermische Energie in das Verdampfen von Wasser investiert. Die gelieferte Wärme ist latent, weil sie die Temperatur nicht erhöhte, sondern zu einer Änderung der Flüssigkeitsphase in die Gasphase führte.
Es ist eine experimentelle Tatsache, dass die sensible Wärme, die erforderlich ist, um eine bestimmte Temperaturvariation zu erreichen, direkt proportional zu dieser Variation und der Masse des Objekts ist.
[TOC]
Konzept und Formeln
Es wurde beobachtet, dass die empfindliche Wärme abgesehen von Massen- und Temperaturdifferenz auch vom Material abhängt. Aus diesem Grund wird die Verhältnismäßigkeitskonstante zwischen der empfindlichen Wärme und dem Produkt der Masse durch die Temperaturdifferenz als spezifische Wärme bezeichnet.
Die Menge an empfindlicher Wärme hängt auch davon ab, wie der Prozess durchgeführt wird. Zum Beispiel ist es anders, wenn der Prozess mit konstantem Volumen als konstanter Druck durchgeführt wird.
Die Formel für empfindliche Wärme in einem Prozess isobar, Das heißt ständigen Druck, es ist wie folgt:
Q = CP . M (tF - TYo)
In der vorherigen Gleichung Q Es ist die empfindliche Wärme, die dem Massenobjekt geliefert wird M, Das hat seine Anfangstemperatur erhöht TYo Bis zum Endwert Tf. In der vorherigen Gleichung erscheint es auch CP, Welches ist die spezifische Wärme des Materials bei konstantem Druck, da der Prozess auf diese Weise durchgeführt wurde.
Beachten Sie, dass empfindliche Wärme positiv ist, wenn sie vom Objekt absorbiert wird und einen Temperaturanstieg verursacht.
In dem Fall, dass ein in einem starrer Behälter eingeschlossenes Gas geliefert wird, wird das Verfahren sein Isocoric, das heißt, bei konstantem Volumen; Und die empfindliche Wärmeformel wird so geschrieben:
Kann Ihnen dienen: Wellenkollegs Bewegung: Eigenschaften, Arten von Wellen, BeispieleQ = cv. M . (TF - TYo)
Der adiabatische Koeffizient γ
Das Verhältnis zwischen der spezifischen Wärme bei konstantem Druck und der spezifischen Wärme bei konstantem Volumen für dasselbe Material oder Substanz wird aufgerufen Adiabatischer Koeffizient, das im Allgemeinen mit dem Gamma Gamma γ -Buchstaben bezeichnet wird.
Er Adiabatischer Koeffizient ist größer als die Einheit. Die Wärme, die erforderlich ist, um die Temperatur eines Gramm -Gramm -Masses auf einen Grad zu erhöhen.
Dies liegt daran, dass im ersten Fall Teil der Wärme für mechanische Arbeiten verwendet wird.
Zusätzlich zur spezifischen Wärme wird die Wärmekapazität eines Körpers normalerweise definiert. Dies ist die Wärmemenge.
Wärmekapazität c
Wärmekapazität wird mit bezeichnet C Großbuchstaben, während die spezifische Wärme mit C Kleinbuchstaben. Die Beziehung zwischen beiden Beträgen ist:
C = Cú m
Wo M Es ist die Masse des Körpers.
Es wird auch molarspezifische Wärme verwendet, die als die Menge an empfindlicher Wärme definiert ist, die für eine Celsius- oder Kelvin -Temperatur erforderlich ist.
Spezifische Wärme in Festkörpern, Flüssigkeiten und Gasen
Die spezifische molare Wärme der meisten Festkörper hat einen Wert nahezu 3 mal R, Wo R Es ist die universelle Konstante der Gase. R = 8,314472 j/(mol ℃).
Zum Beispiel hat Aluminium spezifische Molarenwärme 24.2 j/(mol ℃), Kupfer 24,5 J/(Mol ℃), Gold 25,4 j/(Mol ℃), und süßes Eisen 25.1 j/(mol ℃). Beachten Sie, dass diese Werte nahe stehen 3r = 24,9 J/(Mol ℃).
Andererseits liegt bei den meisten Gasen die spezifische Wärme in der Nähe N (r/2), wo ist N eine Ganzzahl und R Es ist die universelle Konstante der Gase. Die ganze Zahl N hängt mit der Anzahl der Grad der Freiheit des Moleküls zusammen, das das Gas bildet.
Zum Beispiel in einem idealen monoatomischen Gas, dessen Molekül nur die drei Freiheitsgrade hat, ist die spezifische molare Wärme bis zu konstantem Volumen 3 (R/2). Aber wenn es sich um ein ideales Diatomgas handelt, sind zwei Rotationsgrad Cv = 5 (r/2).
Kann Ihnen dienen: Semicircle: Wie berechnet man den Umfang, Fläche, Zentroid, ÜbungenIn den idealen Gasen wird die folgende Beziehung zwischen der spezifischen Wärolwärme und dem konstanten Volumen erfüllt: CP = cv + R.
Seite Erwähnung verdient Wasser. Im flüssigen Zustand bei 25 ℃ Wasser hat CP = 4,1813 j/(g ℃), Wasserdampf bei 100 Grad Celsius hat CP = 2,080 j/(g ℃) Und Wassereis auf Zero Grade Celsius hat CP = 2,050 J/(g ℃).
Unterschied mit latenter Hitze
Materie kann in drei Staaten gefunden werden: fest, flüssig und gasförmig. Um den Zustand zu verändern, ist Energie erforderlich, aber jede Substanz reagiert auf eine andere Weise entsprechend ihren molekularen und atomaren Eigenschaften.
Wenn ein Feststoff schmilzt oder eine Flüssigkeit verdunstet, bleibt die Temperatur des Objekts konstant, bis alle Partikel ihren Status verändert haben.
Daher ist es möglich, dass eine Substanz in zwei Phasen gleichzeitig im Gleichgewicht ist: fest - flüssig oder flüssig - Dampf, zum Beispiel. Eine Menge der Substanz kann durch Hinzufügen oder Entfernen von Wärme von einem Zustand zu einem anderen übergeben, während die Temperatur fest bleibt.
Die Wärme, die einem Material zugeführt wird. Dies führt zu einem Temperaturanstieg.
Es ist möglich, dass die Energie, die sie erwerben, so groß ist, dass sie nicht mehr in ihre Gleichgewichtsposition zurückkehren und die Trennung zwischen ihnen erhöhen. In diesem Fall steigt die Temperatur nicht an, aber die Substanz verläuft von fest zu Flüssigkeits- oder Gasflüssigkeit.
In der Wärme, die erforderlich ist, damit dies geschieht, ist es als bekannt als als latente Hitze. Daher ist latente Wärme Wärme, durch die eine Substanz die Phase ändern kann.
Hier ist der Unterschied mit empfindlicher Wärme. Eine Substanz, die empfindliche Wärme absorbiert.
Wie man latente Wärme berechnet?
Die latente Wärme wird durch Gleichung berechnet:
Q = m . L
Wo L Es kann die spezifische Wärme der Verdampfung oder Fusion sein. Die Einheiten von L Sie sind Energie/Masse.
Wissenschaftler haben zahlreiche Wärme -Konfessionen gegeben, abhängig von der Art der Reaktion, an der er teilnimmt. So gibt es beispielsweise die Reaktionswärme, die Verbrennungswärme, die Erwärmungswärme, die Lösungswärme, die Hitze der Sublimation und viele andere.
Kann Ihnen dienen: Kinetische Energie: Eigenschaften, Typen, Beispiele, ÜbungenDie Werte vieler dieser Wärmetypen für verschiedene Substanzen sind tabellarisch.
Gelöste Übungen
Beispiel 1
Nehmen Sie an, einer mit einem 3 kg Massenaluminium. Anfangs ist es bei 20 ° C und Sie möchten seine Temperatur auf 100 ° C erhöhen. Berechnen Sie die notwendige empfindliche Wärme.
Lösung
Zuerst müssen wir die spezifische Wärme von Aluminium kennenlernen
CP = 0,897 J / (g ° C)
Die Wärmemenge, die zum Erwärmen des Aluminiumstücks erforderlich ist
Q = cP m (tf - ti) = 0,897 * 3000 * (100 - 20) J
Q = 215280 j
Beispiel 2
Berechnen Sie die Wärmemenge, die erforderlich ist, um 1 Liter Wasser von 25 ° C bis 100 ° C auf Meereshöhe zu erhitzen. Drücken Sie das Ergebnis auch in Kilokalorien aus.
Lösung
Das erste, woran wir uns erinnern, ist, dass 1 Liter Wasser 1 kg wiegt, das sind 1000 Gramm.
Q = cP m (tf - ti) = 4,1813 j/(g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 J
Caloria ist eine Energieeinheit, die als die empfindliche Wärme definiert ist, die erforderlich ist, um ein Gramm Wasser zu einem Celsius zu erheben. Daher entspricht 1 Kalorie 4.1813 Joule.
Q = 313597,5 J * (1 CAL / 4,1813 J) = 75000 Kalk = 75 kcal.
Beispiel 3
Ein Stück von 360,16 Grammmaterial wird von 37 ℃ auf 140 ℃ erhitzt. Die gelieferte thermische Energie beträgt 1150 Kalorien.
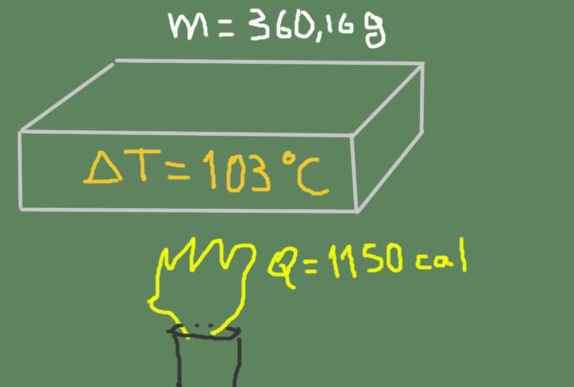 Erhitzen der Probe. Quelle: Selbst gemacht.
Erhitzen der Probe. Quelle: Selbst gemacht. Finden Sie die spezifische Wärme des Materials.
Lösung
Wir können die spezifische Wärme basierend auf empfindlichen Wärme-, Massen- und Temperaturschwankungen gemäß der Formel schreiben:
CP = Q /(m Δt)
Ersetzen der Daten haben wir Folgendes:
CP = 1150 Cal / (360,16 g * (140 ℃ - 37 ℃)) = 0.0310 cal / (g ℃)
Aber als Kalorie entspricht 4.1813 J, kann das Ergebnis auch als ausgedrückt werden
CP = 0,130 j / (g ℃)
Verweise
- Giancoli, d. 2006. Physik: Prinzipien mit Anwendungen. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Physik: Ein Blick auf die Welt. 6ta Abgekürzte Ausgabe. Cengage Lernen. 156 - 164.
- Tippens, p. 2011. Physik: Konzepte und Anwendungen. 7. Überarbeitete Edition. McGraw Hill. 350 - 368.
- Rex, a. 2011. Grundlagen der Physik. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitätsphysik mit moderner Physik. 14th. Band 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Grundlagen der Physik. 9n / A Cengage Lernen. 362 - 374.
- « Troponineigenschaften, Struktur, Funktionen und Tests
- CEPED -Wärmeformeln, wie man sie berechnet und Übungen gelöst »

