Änderungen der Zustandstypen und ihrer Merkmale (mit Beispielen)
- 2872
- 563
- Ibrahim Steuk
Der Zustandsänderungen oder Phase sind ein thermodynamisches Phänomen, bei dem Materie reversible physikalische Veränderungen erfährt. Es wird gesagt, dass es thermodynamisch ist, weil eine Wärmeübertragung zwischen Materie und Umgebung auftritt; Oder was ist das Gleiche, es gibt Wechselwirkungen zwischen Materie und Energie, die zu einer Neuordnung von Partikeln führen.
Die Partikel, die die Statusänderung erleben, bleiben vor und nach demselben gleich. Der Druck und die Temperatur sind wichtige Variablen, wie diese in der einen oder anderen Phase angepasst werden. Wenn ein Zustandswechsel auftritt.
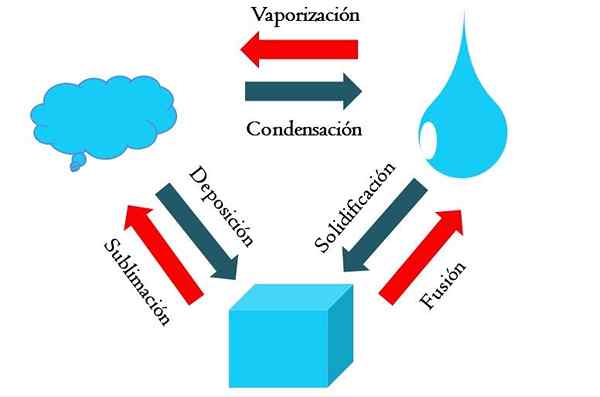
 Zustandsänderungen. Quelle: Gabriel Bolívar
Zustandsänderungen. Quelle: Gabriel Bolívar Das höhere Bild zeigt die Hauptänderungsänderungen, die Materie unter normalen Bedingungen erlebt.
Ein fester Würfel einer bläulichen Substanz kann je nach Temperatur und Druck seiner Umgebung flüssig oder gasförmig werden. Von selbst repräsentiert es eine einzelne Phase: der Feststoff. Aber zum Zeitpunkt des Schmelzens, das heißt schmelzen, ein Feststoffbilanz, der Fusion bezeichnet wird (roter Pfeil zwischen dem Eimer und dem blauen Tropfen wird festgestellt).
Um die Fusion auftreten zu lassen, muss der Würfel Wärme aus seiner Umgebung absorbieren, um seine Temperatur zu erhöhen. Daher ist es ein endothermes Prozess. Sobald der Würfel geschmolzen ist, ist es wieder eine einzige Phase: der des flüssigen Zustands.
Dieser Blota kann weiterhin Wärme absorbieren, was seine Temperatur erhöht und die Bildung von Gasblasen verursacht. Auch hier gibt es zwei Phasen: eine Flüssigkeit und die andere Soda. Wenn die gesamte Flüssigkeit durch ihren Siedepunkt verdunstet ist, wird gesagt, dass sie gekocht oder verdampft hat.
Jetzt wurden bläuliche Tropfen in Wolken umgewandelt. Bisher waren alle Prozesse endothermisch. Bläuliches Gas kann weiterhin Wärme absorbieren, bis es erhitzt wird. Angesichts der terrestrischen Bedingungen kühlt sich dies jedoch im Gegenteil in der Flüssigkeit wieder ab (Kondensation).
Andererseits können Wolken auch direkt in einer festen Phase abgelagert werden, um den festen Würfel erneut zu bilden (Abscheidung). Diese letzten beiden Prozesse sind exotherm (blaue Pfeile); Das heißt, sie geben Wärme in die Umwelt oder um die Umwelt frei.
Zusätzlich zu Kondensation und Ablagerung gibt es eine Zustandsänderung, wenn der Blota bei niedrigen Temperaturen einfriert (Verfestigung).
[TOC]
Arten von Zustandsänderungen und ihre Merkmale
Das Bild zeigt die typischen Änderungen für die drei (am häufigsten) Materiezustände: festen, flüssigen und gasförmigen. Die von den roten Pfeilen begleiteten Änderungen sind endotherm, sie implizieren Wärmeabsorption; Während diejenigen, die von blauen Pfeilen begleitet werden, exotherm sind.
Eine kurze Beschreibung jeder dieser Änderungen wird unten vorgenommen, wobei einige seiner Eigenschaften aus einem molekularen und thermodynamischen Denken hervorgehoben werden.
- Verschmelzung
Fusion ist die Änderung des Zustands einer Substanz vom Festkörper in die Flüssigkeit.

Im Festkörper erheben die Partikel (Ionen, Moleküle, Cluster usw.) sind „Gefangene“, die sich in festen Raumpositionen befinden, ohne sich frei bewegen zu können. Sie sind jedoch in der Lage, bei verschiedenen Frequenzen zu vibrieren, und wenn diese sehr stark sind, wird die strenge Ordnung, die durch intermolekulare Kräfte auferlegt wird.
Infolgedessen werden zwei Phasen erhalten: einer, bei dem die Partikel weiterhin eingesperrt sind (fest) und eine, bei der sie freier (flüssig) sind, genug, um die Entfernungen zu erhöhen, die sie voneinander trennen. Um dies zu erreichen, muss der Feststoff Wärme absorbieren, und somit vibriert seine Partikel mit größerer Kraft.
Es kann Ihnen dienen: Atommasse: Definition, Typen, wie man sie berechnet, BeispieleAus diesem Grund ist die Fusion endotherm, und wenn sie beginnt.
Die Wärme, die erforderlich ist, um diese Änderung zu erzeugenFus). Dies drückt die Wärmemenge (Energie in KJ -Einheiten hauptsächlich) aus.
Schneeball
 Schnee mit der Hand schmelzen. Quelle: Pixabay
Schnee mit der Hand schmelzen. Quelle: Pixabay In diesem Sinne versteht man sich, warum ein Schneeball in der Hand schmilzt (überlegenes Bild). Schnee absorbiert die Körperwärme, die ausreicht, um die Schnee Temperatur über 0 ° C zu erhöhen.
Die im Schnee vorhandenen Eiskristalle absorbieren die richtige Wärme zum Schmelzen und so, dass ihre Wassermoleküle eine ungeordnete Struktur anwenden. Während der Schnee schmilzt, erhöht das gebildete Wasser seine Temperatur nicht, da die gesamte Hitze der Hand den Schnee ausnutzt, um seine Fusion zu vervollständigen.
- Verdampfung

Verdampfung ist die Änderung des Zustands eines Substanz vom flüssigen Zustand zum Gasus.
Wenn Sie das Beispiel des Wassers fortsetzen, nun eine Handvoll Schnee in einen Topf geben und das Feuer anzünden, wird beobachtet, dass der Schnee schnell schmilzt. Wenn Wasser erhitzt wird, beginnen sich kleine Kohlendioxidblasen und andere mögliche Gasverunreinigungen zu bilden.
 Kochendes Wasser. Quelle: Pixabay
Kochendes Wasser. Quelle: Pixabay Die Wärme erweiterte molekular die ungeordneten Konfigurationen des Wassers, erweitert sein Volumen und erhöhte ihren Dampfdruck; Daher gibt es mehrere Moleküle, die dem Oberflächenprodukt einer zunehmenden Verdunstung entkommen.
Flüssigwasser erhöht seine Temperatur aufgrund seiner hohen spezifischen Wärme (4.184J/° C ∙ g) g) langsam). Es gibt einen Punkt, an dem die Wärme, die sie absorbiert, nicht mehr verwendet, um ihre Temperatur zu erhöhen, sondern um das Gleichgewicht zwischen Flüssigkeit und Dampf zu beginnen. Das heißt, es zu kochen und die gesamte Flüssigkeit verläuft in den gasförmigen Zustand, während er Wärme absorbiert und die Temperatur konstant bleibt.
Hier wird eine intensive Blase auf der Oberfläche von gekochtem Wasser beobachtet (überlegenes Bild). Die Wärme, die flüssiges Wasser so absorbiert, dass der Dampfdruck seiner beginnenden Blasen externen Druck entspricht, wird als Verdampfenthalpie bezeichnet (ΔHVAP).
Die Rolle des Drucks
Der Druck ist auch bei staatlichen Veränderungen entscheidend. Was hat sich auf die Verdampfung aus?? Das bei größerem Druck ist die Wärme, die Wasser zum Kochen absorbieren muss, und ist daher über 100 ° C verdampft.
Dies liegt daran.
Drucktöpfe verwenden diese Tatsache zu ihren Gunsten, um Nahrung bei einer Temperatur über ihrem Siedepunkt in Wasser zu erhitzen.
Andererseits benötigt flüssiges Wasser ein Vakuum oder eine Abnahme des Drucks, um eine niedrigere Temperatur zu kochen und zur Gasphase zu fahren. Mit viel oder geringem Druck muss das Wasser zum Zeitpunkt des Kochens seine jeweilige Verdampfungswärme absorbieren, um seine Zustandsänderung zu vervollständigen.
- Kondensation
Kondensation ist die Änderung des Zustands einer Substanz vom gasförmigen Zustand zum flüssigen Zustand.
Kann Ihnen dienen: Galactose
Wasser hat sich verdampft. Was kommt als nächstes? Wasserdampf kann immer noch seine Temperatur erhöhen und zu einem gefährlichen Strom werden, der schwerwiegende Verbrennungen verursachen kann.
Nehmen wir jedoch an, es kühlt stattdessen ab. Als? Wärme in die Umwelt freisetzen, und wenn bei der Wärme freigelassen wird.
Durch die Freisetzung von Wärme beginnen sich die sehr energiegraßen Moleküle zu verlangsamen. Außerdem werden seine Wechselwirkungen effektiver, wenn die Dampftemperatur abfällt. Erstens werden Wassertröpfchen, Dampfkondensat, gefolgt von größeren Tropfen, die sich von der Schwerkraft anziehen, gebildet werden.
Um eine gewisse Menge Dampf vollständig zu kontrollieren, müssen Sie die gleiche Energie, jedoch mit einem entgegengesetzten Vorzeichen, bei ΔH freigebenVAP; das heißt, seine Kondensationenthalpie ΔHKond. Somit ist das umgekehrte, Dampf-Flüssigkeitsbilanz stabil.
Befeuchtete Fenster
 Wasserkondensation. Quelle: Pexels
Wasserkondensation. Quelle: Pexels Kondensation kann in Haushaltsfenstern selbst beobachtet werden. Bei kaltem Wetter kollidiert der im Haus enthaltene Wasserdampf mit dem Fenster, das durch sein Material eine geringere Temperatur aufweist als andere Oberflächen.
Dort ist es für Dampfmoleküle einfacher zu gruppieren und eine dünne weißliche Schicht zu erzeugen, die von Hand leicht abnehmbar ist. Da diese Moleküle Wärme (Heizung und Luft und Luft) freisetzen, bilden sie mehr zahlreiche Cluster, bis sie die ersten Tropfen kondensieren können (oberes Bild).
Wenn die Tropfen ihre Größe stark erhöhen, rutschen sie durch das Fenster und hinterlassen eine Wasserspur.
- Erstarrung
Verfestigung ist die Änderung des Zustands einer Substanz vom flüssigen Zustand zum Festkörperzustand.

Verfestigung erfolgt aufgrund der Abkühlung; Mit anderen Worten, Wasser friert ein. Zum Einfrieren muss das Wasser die gleiche Wärmemenge freisetzen, die Eis zum Schmelzen absorbiert. Auch diese Wärme wird als Verfestigung oder Gefrierenthalpie ΔH bezeichnetCong (-ΔHFus).
Beim Abkühlen verlieren Wassermoleküle Energie und ihre intermolekularen Wechselwirkungen werden stärker und gerichteterer. Infolgedessen werden sie dank ihrer Wasserstoffbrücken bestellt und bilden die sogenannten Eiskristalle. Der Mechanismus, durch den Eiskristalle einen Einfluss auf ihr Aussehen erweitern: transparent oder weiß.
 Eisskulptur. Quelle: Pixabay
Eisskulptur. Quelle: Pixabay Wenn Eiskristalle sehr langsam wachsen. So entkommen Blasen und können nicht mit Licht interagieren; Und folglich gibt es ein Eis, das so transparent ist wie eine außergewöhnliche Eisstatue (überlegenes Bild).
Das gleiche, was mit Eis geschieht, kann mit jeder anderen Substanz passieren, die durch Kühlung verfestigt wird. Vielleicht ist dies die komplexeste physikalische Veränderung der terrestrischen Bedingungen, da mehrere Polymorphen erhalten werden können.
- Sublimation
Sublimation ist die Änderung des Zustands einer Substanz vom Feststoff zum Gas.

Kann untergrüßern? Nein, zumindest nicht unter normalen Bedingungen (t = 25 ° C, p = 1 atm). Für die Sublimation tritt auf, dh die Änderung des Gasfestzustands, der Dampfdruck des Feststoffs muss hoch sein.
Ebenso ist es wichtig, dass ihre intermolekularen Kräfte nicht sehr stark sind, vorzugsweise, wenn sie nur aus Dispersionskräften bestehen
Das emblematischste Beispiel ist ein solides Jod. Es ist ein kristalliner Feststoff aus grau-moralischen Tönen, der einen hohen Dampfdruck aufweist. Dies ist so, dass in seiner Handlung ein lila Dampf folgt, dessen Volumen und Expansion bemerkenswert sind, wenn er sich unterwärmt.
Kann Ihnen dienen: Triethilamin: Struktur, Eigenschaften, Verwendungen und Risiken Sublimation von Jod. Quelle: Belkina n V [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)] aus Wikimedia Commons
Sublimation von Jod. Quelle: Belkina n V [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)] aus Wikimedia Commons Im oberen Bild wird ein typisches Experiment gezeigt, wo fester Jod in einem Glasbehälter verdunstet. Es ist interessant und auffällig zu beobachten.
Dies ist das Hauptmerkmal der Sublimation: Es gibt kein Vorhandensein einer flüssigen Phase. Es ist auch endotherm, da der Feststoff Wärme absorbiert.
- Ablage
 IODO -Kristallentwicklung. Quelle: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons
IODO -Kristallentwicklung. Quelle: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons Die Ablagerung ist die Änderung des Zustands einer Substanz vom gasförmigen Zustand zum Festkörper.
Parallel zum Iod -Sublimation -Experiment haben Sie die Ablagerung, dass. Ablagerung ist die entgegengesetzte Änderung oder Übergang: Die Substanz geht ohne die Bildung einer flüssigen Phase vom gasförmigen Zustand zum Feststoff über.
Wenn Jodvila-Dämpfe mit einer kalten Oberfläche in Kontakt kommen, füllen sie Wärme auf, um sie zu erhitzen, verlieren Energie und gruppieren ihre Moleküle wieder im Grayish-Muddy-Feststoff (überlegenes Bild). Es ist dann ein exothermer Prozess.
Die Ablagerung wird häufig für die Synthese von Materialien verwendet, bei denen sie durch hoch entwickelte Techniken mit Metallatomen dotieren. Wenn die Oberfläche sehr kalt ist, ist der Wärmeaustausch zwischen ihr und den Dampfpartikeln abrupt, wodurch der Durchgang durch die jeweilige Flüssigkeitsphase weggelassen wird.
Die Hitze oder Enthalpie der Ablagerung (und nicht der Ablagerung Ablage) ist das der Sublimation (ΔHSub=- ΔHD.E.P). Theoretisch können zahlreiche Substanzen sublimiert werden, aber um dies zu erreichen, müssen Druck und Temperaturen und Temperaturen nicht nur sein P -V -Diagramm zur Hand haben. In diesem können ihre entfernten möglichen Phasen sichtbar gemacht werden.
Andere Zustandsänderungen
Obwohl sie nicht erwähnt werden, gibt es andere Materiezustände. Manchmal sind sie durch "ein bisschen von jedem" und damit eine Kombination von ihnen gekennzeichnet. Um sie zu erzeugen, sollten Drücke und Temperaturen zu sehr positiven (großen) oder negativen (kleinen) Größen manipuliert werden.
Wenn die Gase beispielsweise stark erhitzt werden, verlieren sie ihre Elektronen und ihre positiv beladenen Kerne in dieser negativen Flut das so genannte Plasma. Es ist ein Synonym für "elektrisches Gas", da es eine hohe elektrische Leitfähigkeit aufweist.
Andererseits kann sich die Materie nicht erwartet verhalten, wenn die Temperaturen zu viel absteigen. Das heißt, sie zeigen einzigartige Eigenschaften um absolute Null (0 K).
Eine dieser Eigenschaften ist Überflüssigkeit und Superkonditionivität; sowie die Bildung von Bose-Einstein-Kondensat, bei dem sich alle Atome als einer verhalten.
Sogar einige Untersuchungen weisen auf photonische Materie hin. In ihnen werden die Teilchen der elektromagnetischen Strahlung, die Photonen, zu photonischen Molekülen gegründet. Das heißt, es würde theoretisch einige Lichtkörper messen,.
Verweise
- Helmestine, Anne Marie, ph.D. (19. November 2018). Liste der Phasenänderungen zwischen Materiezustand. Erholt von: thoughtco.com
- Wikipedia. (2019). Aggregatszustand. Abgerufen von: in.Wikipedia.Org
- Dorling Kindersley. (2007). Zustand wechseln. Erholt von: factmonster.com
- Meyers Ami. (2019). Phasenänderung: Verdunstung, Kondensation, Frezierung, Schmelzen, Sublimation und Ablagerung. Lernen. Erholt von: Studium.com
- Bagley m. (11. April 2016). Materie: Definition und die fünf Materiezustände. Erholt von: Livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- « Zweites Gesetz der Thermodynamikformeln, Gleichungen, Beispiele
- Kaliumiodid (KI) -Struktur, Eigenschaften, erhalten, verwendet, Risiken »

