Valencia -Schicht
- 2636
- 275
- Frederike Birkemeyer
 In der Valencia -Schicht treten chemische Reaktionen auf
In der Valencia -Schicht treten chemische Reaktionen auf Was ist die Valencia -Schicht?
Der Valencia -Schicht Es ist das, deren Elektronen für die chemischen Eigenschaften eines Elements verantwortlich sind. Die Elektronen in dieser Schicht interagieren mit denen eines benachbarten Atoms, um kovalente Bindungen (A-B) zu bilden; Und wenn sie von einem Atom zu einem anderen elektronegativen, ionischen Verbindungen (A+B-) auswandern (A+B-).
Diese Schicht wird durch die Hauptquantenzahl definiert N, was wiederum den Zeitraum angibt, in dem sich das Element in der Periodenzüchter befindet. Während die Bestellung nach Gruppen von der Anzahl der Elektronen abhängt, die in der Valencia -Schicht umkreisen.
So dass für a N In Höhe von 2 können Sie acht Elektronen besetzen: acht Gruppen (1-8).
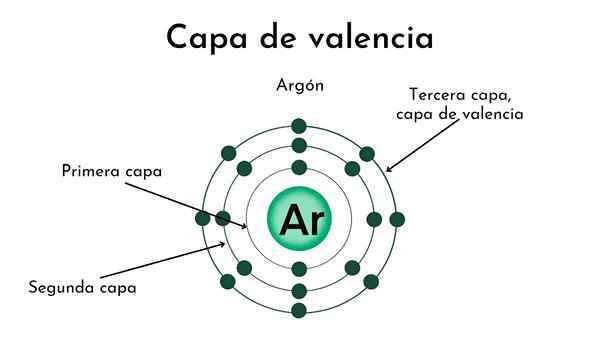
 Kern eines Atoms mit vier Schichten. Quelle: Gabriel Bolívar
Kern eines Atoms mit vier Schichten. Quelle: Gabriel Bolívar Im oberen Bild und die Abdeckung wird die Bedeutung der Valencia -Schicht dargestellt. Der schwarze Punkt in der Mitte des Atoms ist der Kern, während die verbleibenden konzentrischen Kreise die elektronischen Schichten sind N.
Wie viele Schichten hat dieses Atom?? Jeder von ihnen hat seine eigene Farbe, und wenn es vier gibt, hat das Atom vier Schichten (N= 4).
Beachten Sie, dass sich die Farbe verschlechtert, wenn der Abstand von der Schicht zum Kern zunimmt. Die Valencia -Schicht ist diejenige, die weiter vom Kern entfernt ist: die klarste Farbe.
Was ist die Valencia -Schicht?
Nach dem Bild ist die Valencia -Schicht nichts anderes als die letzten Orbitale eines von Elektronen besetzten Atoms. In der hellblauen Schicht für N= 4 Es gibt eine Reihe von 4S-, 4P-, 4D- und 4F -Orbitalen; Das heißt, im Inneren gibt es andere Unterkompanien mit unterschiedlichen elektronischen Fähigkeiten.
Ein Atom benötigt Elektronen, um alle 4N -Orbitale zu füllen. Dieser Prozess kann in den elektronischen Konfigurationen der Elemente über einen Zeitraum beobachtet werden.
Kann Ihnen dienen: Lineare Alkane: Struktur, Eigenschaften, Nomenklatur, BeispieleZum Beispiel hat Kalium eine elektronische Konfiguration [AR] 4s1, Während Kalzium zu Ihrem Recht [ar] 4s2.
Was ist die Valencia -Schicht nach diesen Konfigurationen?? Der Begriff [AR] bezieht sich auf die elektronische Konfiguration von edlem Argon 1S -Gas22s22 p63s23p6. Dies repräsentiert die innere oder geschlossene Schicht (die auch als bekannt ist als Kernel).
Da das 4S -Orbital das mit der größten Energie ist und in dem die neuen Elektronen eintreten, repräsentiert es die Valenzschicht sowohl für den K als auch für die CA. Wenn die Atome von K und Ca mit der des Bildes verglichen würden, wären [ar] alle inneren Blauschichten; und 4s die hellblaue Schicht, die äußere.
Valencia -Schichteigenschaften
Aus dem obigen können einige Eigenschaften der Valencia -Schicht für alle Atome zusammengefasst werden:
-Sein Energieniveau ist höher; Was gleich ist, ist mehr aus dem Kern zurückgezogen und hat die niedrigste elektronische Dichte (im Vergleich zu anderen Schichten).
-Es ist unvollständig. Daher wird es weiterhin mit Elektronen gefüllt, da ein Zeitraum von links nach rechts im Periodensystem unterwegs ist.
-Interveniert in die Bildung kovalenter oder ionischer Verbindungen.
Bei Kalium- und Calciummetallen oxidieren sie, um sich in Kationen zu verwandeln. Das K+ Es verfügt über eine elektronische Konfiguration [AR], da es sein einziges 4S -externes Elektron verliert1. Und auf der Seite der ca2+, Seine Konfiguration ist auch [AR]; Denn anstatt ein Elektron zu verlieren, verliert es zwei (4s2).
Aber was ist der Unterschied zwischen k+ und die ca2+, Wenn beide die Elektronen ihrer Valenzschicht verlieren und eine elektronische Konfiguration haben [AR]? Der Unterschied liegt in seinen ionischen Radios.
Kann Ihnen dienen: Quecksilberoxid (HG2O)AC2+ ist kleiner als k+ Weil das Calciumatom ein zusätzliches Proton hat, das externe Elektronen (geschlossen oder valencia) mehr Kraft anzieht).
Die Valencia 4S -Schicht ist nicht verschwunden: Sie ist nur für diese Ionen leer.
Beispiele für Valencia -Schicht
Das Konzept der Valencia -Schicht kann direkt oder indirekt in vielen Aspekten der Chemie sein.
Weil ihre Elektronen diejenigen sind, die an der Bildung von Bindungen teilnehmen, jedes Thema, das sie anspricht (TEV, RPECV, Reaktionsmechanismen usw.) Sie müssen sich auf die Schicht beziehen.
Dies liegt daran, dass sie, was wichtiger ist als die Valenzschicht. Bei der Darstellung der fortschreitenden Konstruktion elektronischer Konfigurationen definieren sie die elektronische Struktur des Atoms und damit seine chemischen Eigenschaften.
Aus diesen Informationen von einem Atom A und einem anderen B können die Strukturen ihrer Verbindungen durch Lewis 'Strukturen aufgestellt werden. Ebenso können die elektronischen und molekularen Strukturen eines Verbindungsbereichs dank der Anzahl der Valenzelektronen bestimmt werden.
Die möglichen und einfachsten Beispiele für Valenzschichten befinden sich in der Periodenzüchter. Insbesondere in elektronischen Konfigurationen.
Beispiel 1
Es ist möglich, ein Element und seinen Standort in der Periodenzüchter nur mit elektronischer Konfiguration zu identifizieren. Wenn also ein Element X Konfiguration [KR] 5s hat25 p1, Worum geht es und welche Zeit und Gruppe gehören?
Angesichts der N= 5, x ist in der fünften Periode. Darüber hinaus hat es drei Elektronen Valencia: zwei im 5S -Orbital2 Und einer von 5p1. Die innere Schicht [KR] liefert keine weiteren Informationen.
Es kann Ihnen dienen: Bromhydsäure (HBR)Da X drei Elektronen hat und seine 5p -Orbitale unvollständig sind, befindet es sich in Block P; Darüber hinaus in Gruppe IIIA (Romanesque) oder 13 (aktuelles Nummernsystem durch die IUPAC). X ist dann das indische Element in.
Beispiel 2
Was ist das X -Element mit elektronischer Konfiguration [KR] 4D105s1? Beachten1 ist die meiste Energie. Die Valencia -Schicht umfasst jedoch auch 4D -Orbitale, da sie es sind unvollständig.
Valencia -Schichten können dann als NSNP für ein Element des P- oder S -Blocks bezeichnet werden. oder (n-1) dns für ein Element von Block D. So dass das mysteriöse Element X zu Block D gehört, weil seine elektronische Konfiguration vom Typ (N-1) DNS (4D) ist105s1).
Welche Gruppe gehört? Hinzufügen der zehn Elektronen des 4D -Orbitals10, und einer von 5s1, X hat elf Elektronen aus Valencia. Daher muss es sich in Gruppe ib u 11 befinden. Reisen Sie dann Zeit 5 des Periodensystems bis in Gruppe 11, bis Sie das Silberelement erreichen, AG.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie (vierte Ausgabe, p. 23). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Chemie (8. Aufl.). Cengage Learning, p. 287.
- NDT Resource Center (s.F.). Die Valenzschale. Genommen von: nde-ed.Org
- Clackamas Community College (2002). Valenzelektronen. Abgerufen von: dl.Clackamas.Edu
- Chemistry Librettexts (s).F.). Valenz- und Kernelektronen. Erholt von: Chem.Librettexts.Org

