Carbocation -Bildung, Eigenschaften, Typen, Stabilität
- 3614
- 814
- Joy Hort
A Carbokation, Wie der Name schon sagt, handelt es sich um ein organisches Ion mit einem positiv beladen. Es ist normalerweise ein Vermittler bei organischen Reaktionen, dh es stammt als unverzichtbare Schritte der jeweiligen molekularen Mechanismen.
Historisch gesehen gab es Konfliktpunkte bei der Komprimierung dessen, was Carbokation ist. Dies liegt daran, dass es Symphine von reaktiv. Klassiker Carbocation ist sozusagen eine, die durch die allgemeine Formel des Bildes unten dargestellt werden kann.
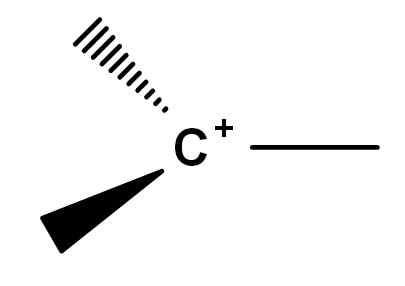 Allgemeine Formel einer Carbokation. Quelle: Gabriel Bolívar.
Allgemeine Formel einer Carbokation. Quelle: Gabriel Bolívar. Beachten Sie, wie sich die positive Belastung genau auf dem Kohlenstoffatom befindet, und es fehlt auch eine Verbindung. Daher sind Carbokation schlechte Elektronen, dies ist die Ursache für seine hohe Reaktivität.
Angenommen Methan, Cho4. Wenn Carbon eine seiner Wasserstoffatome verlor, würden wir eine der vier C-H-Bindungen beseitigen. Dann entstand die Methylcarbokation, CH3+, was wir nur darstellen konnten, indem wir die Wasserstoffatome an den Enden der Streifen der oberen Formel platzieren. Das CH3+ Es ist das einfachste aller Karbokationen.
[TOC]
Ausbildung
Wie bilden sich Karobokationen?? Die Antwort findet sich in Reaktionenmechanismen. Die überwiegende Mehrheit hat jedoch gemeinsam einen der folgenden zwei Aspekte:
-Heterolytischer Bruch
-Zugabe von Elektronen π zu einem Elektrophilen
Heterolytischer Bruch
In der heterolithischen Bruch ist die C-G-Bindung, die ein Atom oder eine Gruppe ist, in ungleichen Weise gebrochen: Die Elektronen der Bindung werden g gelassen, während das Kohlenstoffatom eine positive Belastung erlangt. Zum Beispiel:
Kann Ihnen dienen: Arsen: Geschichte, Struktur, Eigenschaften, verwendet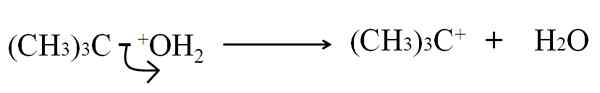 Heterolytische Bruch bei Tertbutanol -Dehydration. Quelle: Gabriel Bolívar.
Heterolytische Bruch bei Tertbutanol -Dehydration. Quelle: Gabriel Bolívar. Jetzt kann diese Pause für verschiedene Methoden verabreicht werden, die wiederum den Mechanismus und die Reaktion verändern werden.
Zugabe von Elektronen π zu einem Elektrophilen
Der andere Prozess, durch den eine Carbokation gebildet wird und in aromatischen Alkenen und Verbindungen sehr häufig ist, besteht darin, Elektronen einer Doppelbindung auf einen Elektrophilen anzugreifen. Die häufigsten Fälle sind die Hydrierung von Alkenen durch die Wirkung einer Säure:
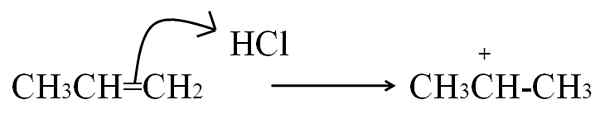 HCl -Reaktion mit dem Propeno, um eine Carbokation als Vermittler zu bilden. Quelle: Gabriel Bolívar.
HCl -Reaktion mit dem Propeno, um eine Carbokation als Vermittler zu bilden. Quelle: Gabriel Bolívar. Diese Gleichung entspricht der Bildung der Carbokation, die es ist ein Vermittler, Kein Produkt. Die Doppelbindungselektronen greifen HCl -Wasserstoff an, den Elektrophilen. Wasserstoff wird zu Kohlenstoff rechts von der Doppelbindung zugesetzt3, Während der Kohlenstoff links die positive Belastung erlangt.
Eigenschaften
Hybridisierung
Die am Anfang vorgestellte allgemeine Formel zeigt eine trigonale flache Geometrie um das Kohlenstoffatom. Dies ist auf die Hybridisierung zurückzuführen, die von Kohlenstoffatomarbitalen erlitten wurde, um hybride sp -Orbitale zu werden2, die in einem Winkel von 120 ° getrennt sind. Obwohl es nicht vertreten ist, hat Carbokation ein Orbital P Rein und leer, in der Lage, Elektronen zu akzeptieren.
Säure
Carbokation ist eine saure Spezies, entweder gemäß der Definition von Brönsted oder Lewis. Ihre positiven Ladungsbedarfelektronen oder Wasserstoffatome, die verabreicht werden. Aus diesem Grund können Karobokationen in sehr grundlegenden Medien nicht gebildet werden, da sie sofort darauf reagieren, um andere Produkte zu stammen.
Stabilität
Die Hybridisierung sp2 von Carbocation macht es anfällig für Angriffe reichhaltiger Arten in Elektronen. Diese Funktion wird durch ihre große Säure weiter betont. Infolgedessen ist Carbocation eine sehr reaktive Spezies, die kaum gebildet wird, und bald (in wenigen Nanosekunden) reagieren Sie, um das wahre Produkt der chemischen Reaktion hervorzurufen.
Kann Ihnen dienen: Sulfaminsäure: Struktur, Eigenschaften, Synthese, verwendetArten von Karbokationen
Es gibt verschiedene Arten von Karbokationen. Diese können jedoch wie folgt klassifiziert werden:
-Primär
-Sekundär
-Tertiär
-Aromatisch oder Arillos
-Vinyl und Alilic
Primär
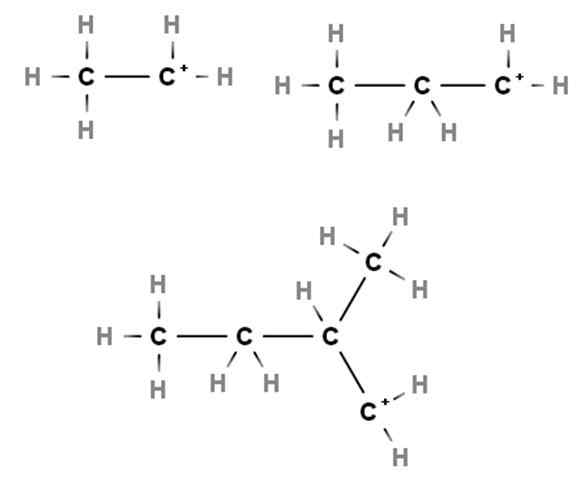 Primärkarbokationen. Quelle: Gabriel Bolívar über Molview.
Primärkarbokationen. Quelle: Gabriel Bolívar über Molview. Ankünfte zeigen Beispiele für primäre Karabokationen. Sie werden so genannt, weil die positive Belastung in einem primären Kohlenstoff 1 liegt, daher ist sie nur mit einem Kohlenstoffatom verbunden. Etano, Ch3CH3, Wenn ein H eines seiner Ziele verliert, Carbocation Cho3CH2+ entweder +CH2CH3.
Sekundär
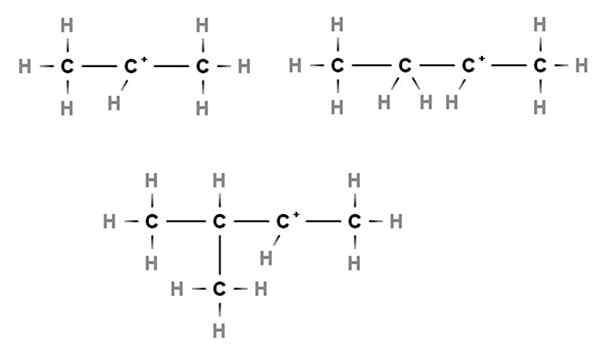 Sekundärkarbokationen. Quelle: Gabriel Bolívar über Molview.
Sekundärkarbokationen. Quelle: Gabriel Bolívar über Molview. In Sekundärkarbokationen befindet sich die positive Belastung in einem sekundären Kohlenstoff 2., der mit zwei Kohlenstoffatomen verbunden ist. Zum Beispiel, wenn das Propan, Cho3CH2CH3, Wir nehmen ein h des zentralen Kohlenstoffs weg, wir werden die Carbocation Cho haben3CH2+CH3.
Tertiär
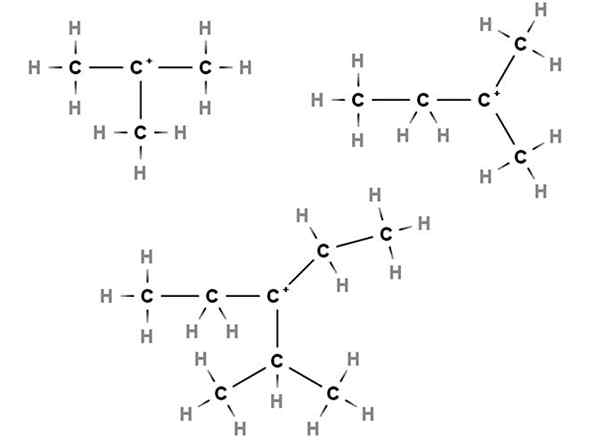 Tertiärkarbokationen. Quelle: Gabriel Bolívar über Molview.
Tertiärkarbokationen. Quelle: Gabriel Bolívar über Molview. In Tertiärkarbokationen befindet sich die positive Belastung in einem tertiären Kohlenstoff, 3., der mit drei Kohlenstoffatomen verbunden ist. Beachten.
Daher haben wir Methylpropan oder Isobutan, CH (CH (wählen3)3, Die durch den Verlust eines Wasserstoffs der zentrale Kohlenstoff Carbokation bildet +C (Ch3)3.
Aromatisch
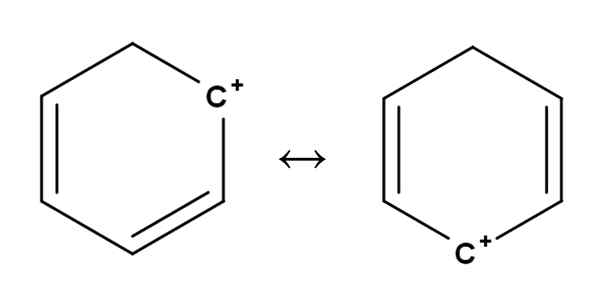 Benzol Carbocat. Quelle: Gabriel Bolívar.
Benzol Carbocat. Quelle: Gabriel Bolívar. Aromatische oder aromatische Karbokationen sind vielleicht die besonderen von allen. Ihr Training ist dem für Alkene im ersten Abschnitt beschriebenen sehr ähnlich.
In ihnen befindet sich die positive Belastung im Prinzip in einem der Kohlenstoffe eines aromatischen Rings wie dem Benzol. Die positive Belastung ist jedoch nicht festgelegt, sondern in anderen Ringpositionen durch Resonanz verteilt.
Es kann Ihnen dienen: Ribulosa-1,5-Biphosphat (RUBP): Eigenschaften, CarbolixationSo fließt die positive Belastung, wie oben gesehen, von einem Kohlenstoff zum anderen im Benzolring übergeht. Diese Eigenschaft verleiht dieser Carbokation eine große Stabilität gegenüber den anderen Arten von Karbokationen.
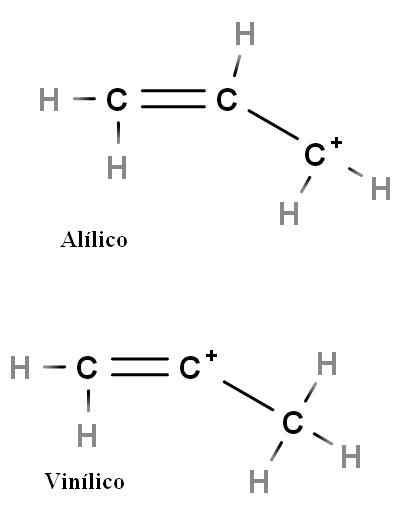
Allyl- und Vinyl
 Allyl- und Vinylcarbokation. Quelle: Gabriel Bolívar.
Allyl- und Vinylcarbokation. Quelle: Gabriel Bolívar. Andere besondere Arten von Karbokationen sind alilisch und vinyl. Der Unterschied zwischen ihnen (oben) ist die Position der positiven Ladung im Zusammenhang mit der Doppelbindung.
In der Vinylcarbokation findet sich die positive Last in einer der Doppelbindungskohlenstoffe; Während der Allyic Carbocation befindet sich die positive Belastung im Kohlenstoff nach der Doppelbindung. Es reicht aus, Hydrlogen durch andere Gruppen zu ersetzen, und wir werden eine riesige Familie von Ally- und Vinylcarbokationen haben.
Relative Stabilität
Da sie wissen, welche Haupttypen von Karbokationen sind, können sie auf der Grundlage ihrer relativen Stabilität bestellt werden:
Vinyl < Primario < Secundario < Alílico < Terciario < Aromático
Jetzt kann es Allic Carbocations geben, die stabiler sind als eine bestimmte Tertiär. Alles hängt von ihren Substituenten ab.
Warum diese Stabilität? Zur Fähigkeit des Moleküls, die positive Ladung der Carbokation zu zerstreuen oder zu verringern. Dazu benötigen Sie enge Atome, die durch Hyperconjugation einen Teil seiner elektronischen Carbocation -Dichte verleihen. In der Zwischenzeit wird dies in alumischen und aromatischen Karbokationen durch Resonanz erreicht.
Im Fall von Vinylcarbokation befindet sich die positive Belastung auf einem Kohlenstoff, der bereits SP war2, was es sehr instabil macht.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Carbokation. Abgerufen von: in.Wikipedia.Org
- James Ashenhurst. (20. Februar 2020). 3 Faktoren, die Karbokationen stabilisieren. Erholt von: Masterorganicchemistry.com
- Clark Jim. (2000). Karobokationen (oder Carboniumionen). Erholt von: Chemguide.CO.Vereinigtes Königreich
- DR. Kennepohl, Prof. S. Farmer & t. Soderberg. (10. August 2020). Carbokationsstruktur und Stabilität. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- « Konzept, Merkmale und Beispiele für Umweltethische Codes, Codes
- Die 4 Stationen des Jahres in Mexiko und seine Merkmale »

