Ammoniumcarbonat ((NH4) 2CO3)
- 3323
- 1045
- Tizian Liebich
Was ist Ammoniumcarbonat?
Er Ammoniumcarbonat Es ist ein anorganisches Stickstoffsalz, insbesondere ammoniakal, dessen chemische Formel ist (NH4)2CO3. Es wird durch Synthesemethoden ausgearbeitet, unter denen es die Sublimation einer Mischung aus Ammoniumsulfat und Calciumcarbonat verwendet hat: (NH4)2SW4(s)+ Caco3(s) => (NH4)2CO3(s)+ Fall4(S).
Im Allgemeinen werden Ammoniumsalze und Calciumcarbonat in einem Behälter erhitzt, um Ammoniumcarbonat zu verursachen. Die industrielle Methode, die Tonnen dieses Salzes erzeugt.
Die Dämpfe, die Ammonium, Kohlendioxid und Wasser enthalten3(g)+ h2Oder (l) + co2(g) → (NH4)2CO3(S). In der Reaktionskarzbonsäure tritt H auf, h2CO3, Nach dem Auflösen von Kohlendioxid im Wasser, und es ist diese Säure, die ihre beiden Protonen hervorruft, h+, zu zwei Ammoniakmolekülen.
Ammoniumcarbonateigenschaften
 Aussehen von Ammoniumcarbonat
Aussehen von Ammoniumcarbonat Es ist ein weißer, kristalliner und farbloser Feststoff mit starken Gerüchen und Ammoniakaromen. Schmilzt auf 58 °.
Diese Zersetzung tritt jedoch in zwei Schritten auf: Erster ein NH -Molekül wird freigesetzt3, Herstellung von Ammoniumbicarbonat (NH4HCO3); Und zweitens, wenn die Heizung fortgesetzt wird, ist Carbonat unverhältnismäßig.
Es ist ein fester Lösungsmittel in Wasser und weniger löslich in Alkoholen. Bildung von Wasserstoffbrücken mit Wasser und wenn sich 5 Gramm in 100 Gramm Wasser auflösen, erzeugt es eine Grundlösung mit einem pH um 8,6.
Kann Ihnen dienen: Emulgator: Emulsionsprozess, molekulare Aspekte, AnwendungenSeine hohe Affinität zum Wasser wird durch einen hygroskopischen Feststoff (es absorbiert Feuchtigkeit), und deshalb ist es schwierig, sie in seiner anhydriden Form zu finden. In der Tat seine Monohydratform (NH4)2CO3· H2O) ist das häufigste von allen und erklärt, wie Salz ein Ammoniakgasträger ist und Geruch verursacht.
In der Luft bricht es zusammen, um Ammoniumbicarbonat und Ammoniumcarbonat (NH) zu erzeugen4NH2CO2).
Chemische Struktur
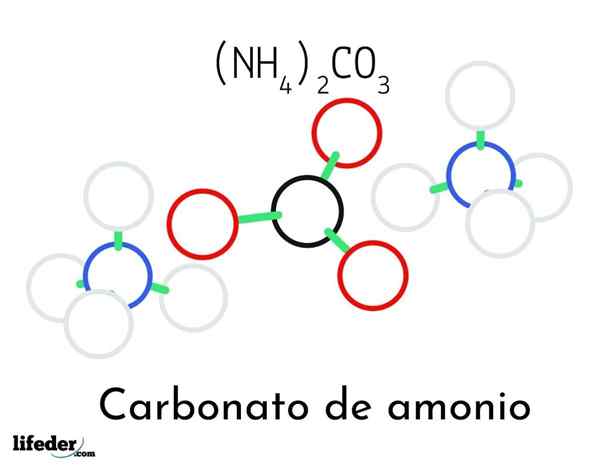
 Ammoniumcarbonatstrukturmodell; Zwei Ammonium- und ein Carbonatkationen
Ammoniumcarbonatstrukturmodell; Zwei Ammonium- und ein Carbonatkationen Im überlegenen Bild wird die chemische Struktur von Ammoniumcarbonat veranschaulicht. In der Mitte ist der Anion Co32-, das flache Dreieck mit dem schwarzen Zentrum und den roten Kugeln; Und zu ihren beiden Seiten, die Ammonios nh Kationen4+ mit tetraedrischen Geometrien.
Die Ammoniumionengeometrie wird durch SP -Hybridisierung erklärt3 des Stickstoffatom. Unter den drei Ionen werden durch Wasserstoffbrücken (H) festgelegt3N-H-o-Co22-).
Dank seiner Geometrie eine einzelne Co -Anion32- kann bis zu drei Wasserstoffbrücken bilden; während NH -Kationen4+ Vielleicht können sie ihre entsprechenden vier Wasserstoffbrücken aufgrund der elektrostatischen Abstoßungen unter ihren positiven Ladungen nicht bilden.
Das Ergebnis all dieser Wechselwirkungen ist die Kristallisation eines ortorrombischen Systems. Warum ist es so hygroskopisch und wasserlöslich? Die Antwort liegt im gleichen vorherigen Absatz: Wasserstoffbrücken.
Diese Wechselwirkungen sind dafür verantwortlich, dass die schnelle Wasseraufnahme von washridtem Salz bildet (NH4)2CO3· H2ENTWEDER). Dies führt zu Änderungen der räumlichen Anordnung der Ionen und daher in der kristallinen Struktur.
Es kann Ihnen dienen: Nickelchlorid (NICL2): Struktur, Eigenschaften, erhalten, verwendet, verwendetStrukturelle Kuriositäten
Egal wie einfach das (NH sieht aus4)2CO3, Es ist so empfindlich gegenüber unzähligen Transformationen, dass seine Struktur ein Rätsel ist, das der wahren Zusammensetzung des Feststoffs eingereicht wurde. Diese Struktur variiert auch je nach Drücken, die die Kristalle beeinflussen.
Einige Autoren haben festgestellt, dass Ionen als Coplanares geordnet werden, die von Wasserstoffbrücken ausgekleidet sind (dh eine Kette mit einer NH -Sequenz4+-CO32--…), In denen Wassermoleküle wahrscheinlich als Anschlüsse für andere Ketten dienen.
Noch mehr, um den terrestrischen Himmel zu überschreiten, wie sind diese Kristalle unter räumlichen oder interstellaren Bedingungen? Was sind Ihre Zusammensetzungen in Bezug auf die Stabilität kohlensäurehaltiger Arten?? Es gibt Studien, die die große Stabilität dieser Kristalle bestätigen, die in den Eismassen planetarisch und Kometen gefangen sind.
Dies ermöglicht es ihnen, als Kohlenstoff-, Stickstoff- und Wasserstoffreserven zu dienen, die nach Sonneneinstrahlung in organisches Material wie Aminosäuren umgewandelt werden können.
Das heißt. Aus diesen Gründen nimmt ihr Interesse an dem Bereich der Astrobiologie und Biochemie zu.
Verwendet/Anwendungen
Es wird als Lauer verwendet, da die Erhitze Kohlendioxid- und Ammoniumgase produziert. Ammoniumcarbonat ist, wenn Sie möchten, ein Vorläufer des modernen Backpulver.
Die Verwendung zum Backen von Kuchen wird jedoch nicht empfohlen. Aufgrund der Dicke der Kuchen bleiben die Ammoniumgase im Inneren und erzeugen einen unangenehmen Geschmack.
Es kann Ihnen dienen: Cyclohexen: Struktur, Eigenschaften, Synthese und VerwendungEs wird als Expektorant verwendet, das heißt, das Husten beim Ableiten der Bronchi lindert. Es hat Fungizidaktion, die aus diesem Grund in der Landwirtschaft verwendet wird. Es ist auch ein Regulator der Säure in Lebensmitteln und wird bei hohen Drücken und Hidantoinas in der organischen Harnstoffsynthese verwendet.
Risiken
Ammoniumcarbonat ist sehr giftig. Es erzeugt beim Menschen eine akute Reizung der Mundhöhle, wenn sie in Kontakt gebracht werden.
Außerdem verursacht aufgenommene Magenreizungen. Eine ähnliche Wirkung wird in den Augen beobachtet, die Ammoniumcarbonat ausgesetzt sind.
Inhalation von Salzzersetzungsgasen, kann Nase, Rachen und Lungen reizen, Husten und Atemnot verursachen.
Akute Hundexposition gegen Ammonatammonat bei einer Dosis von 40 mg/kg Gewicht, verursacht Erbrechen und Durchfall. Die höchsten Dosen von Ammoniumcarbonat (200 mg/kg Gewicht) sind normalerweise tödlich. Herzschaden wird als Todesursache angezeigt.
Wenn es bei sehr hohen Temperaturen und mit Sauerstoff angereicherer Luft erhitzt wird, gibt es giftige Gase ab2.
Verweise
- Pubchem. (2018). Ammoniumcarbonat. Abgerufen am 25. März 2018 aus Pubchem: Pubchem.NCBI.NLM.NIH.Regierung
- Organisches Chemiesportal. ((2009-2018)). Bucherer-Bergs Reaktion. Abgerufen am 25. März 2018 vom organischen Chemiesportal: www.Organische Chemie.Org
- Wikipedia. (2018). Ammoniumcarbonat. Abgerufen am 25. März 2018 aus Wikipedia: in.Wikipedia.Org
- Die chemische Firma. (2018). Die chemische Firma. Abgerufen am 25. März 2018 vom Chemieunternehmen: Thechemco.com