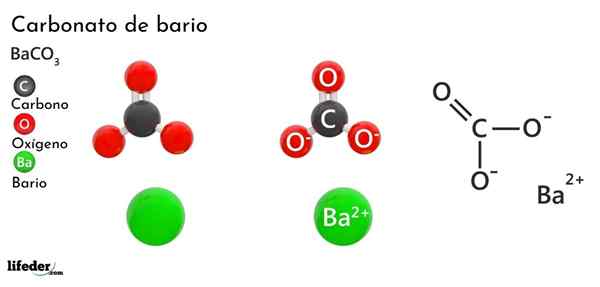
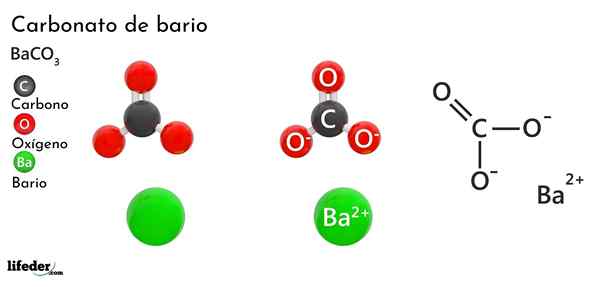
Bariumcarbonat (BACO3)
- 4274
- 608
- Jasmine Kupprion
Was ist Bariumcarbonat?
Er Bariumcarbonat Es handelt sich. Seine chemische Formel ist Bacchus3 Und es ist auf dem Markt in Form eines weißen kristallinen Staubes erhältlich.
Wie wird es erhalten?? Metall Barium kommt in Mineralien wie dem Barite (Baso4) und der Whiterit (Bacchus3). Whiterite ist mit anderen Mineralien verbunden, die im Austausch gegen Farbfärbungen Reinheitspegel für seine weißen Kristalle verbleiben.
Bacchus erzeugen3 der synthetischen Verwendung ist erforderlich, um die Verunreinigungen des Whiterits zu beseitigen, wie dies durch die folgenden Reaktionen angezeigt wird:
Bacchus3(s unrein) + 2nh4Cl (s) + q (Hitze) => bacl2(aq) + 2nh3(g) + h2Oder (l) + co2(G)
Bacl2(aq) + (NH4)2CO3(s) => bacchus3(s) + 2nh4Cl (aq)
Die Barita ist jedoch die Hauptquelle für Barium, und deshalb beginnen die industriellen Produktionen von Bariumverbindungen davon. Dieses Mineral synthetisiert Bariumsulfid (BAS), ein Produkt, aus dem die Synthese anderer Verbindungen und Bacchus fließt3:
Bas (s) + na2CO3(s) => bacchus3(s) + na2H.H)
Bas (s) + co2(g) + h2Oder (l) => bacchus3(s) + (NH4)2S (aq)
Bario -Carbonateigenschaften
 Bariumcarbonatstaub
Bariumcarbonatstaub Es ist staubig, weiß und kristalline. Es ist Toilette, enträtselt und sein Molekulargewicht beträgt 197,89 g/mol. Es hat eine Dichte von 4,43 g/ml und einen nicht existierenden Dampfdruck.
Es hat eine Brechungsraten von 1.529, 1.676 und 1.677. Die Witherita emittiert Licht, wenn es ultraviolette Strahlung absorbiert: von einem hellweißen Licht mit bläulichen Tönen bis zu einem gelben Licht.
Es ist sehr unlöslich in Wasser (0,02 g/l) und in Ethanol. In HCl -Säure -Lösungen bildet das lösliche Bario -Chloridsalz (BACL2), was seine Löslichkeit in diesen sauren Medien erklärt. Im Fall von Schwefelsäure schlägt die unlösliche Salzbasis aus4.
Kann Ihnen dienen: Beryloxid (Beeo)Bacchus3(s) + 2HCl (aq) => bacl2(aq) + co2(g) + h2Oder (l)
Bacchus3(s) + h2SW4(aq) => Baso4(s) + co2(g) + h2Oder (l)
Da es ein ionischer Feststoff ist, ist es auch in den apolaren Lösungsmitteln unlöslich. Das Bariumcarbonat schmilzt bei 811 ºC; Wenn die Temperatur um 1380-1400 ° C zunimmt, erleidet die salzige Flüssigkeit eine chemische Zersetzung anstatt zu kochen. Dieser Prozess tritt für alle Metallcarbonate auf: MCO3(s) => Mo (s) + co2(G).
Wärmeabzersetzung
Bacchus3(s) => bao (s) + co2(G)
Wenn ionische Feststoffe durch sehr stabile Kennzeichnung gekennzeichnet sind, warum brechen Carbonate dann zusammen? Verändert das Metall die Temperatur, bei der der feste Abbau fällt?? Die Ionen, aus denen Bariumcarbonat besteht2+ und co32-, beide sperrig (dh mit großen ionischen Radios). Die co32- Er ist für die Zersetzung verantwortlich:
CO32-(s) => o2-(g) + co2(G)
Das Oxidion (oder2-) Metall ist mit Metall, Metalloxid verbunden. MO erzeugt eine neue ionische Struktur, in der in der Regel die Größe seiner Ionen in der Regel die resultierende Struktur (Netzwerkenthalpie) umso stabiler ist (Netzwerkenthalpie). Das Gegenteil geschieht, wenn die Ionen m+ ICH2- Sie haben sehr ungleiche ionische Radios.
Wenn die Netzwerkenthalpie groß ist, wird die Zersetzungsreaktion energetisch bevorzugt, wobei niedrigere Heiztemperaturen (niedrigere Siedepunkte) geringfügig erforderlich sind).
Andererseits, wenn Mo ein kleines Netzwerkenthalpie hat (wie im Fall von Bao, wo BA2+ Es hat ein größeres ionisches Radio als oder2-) Die Zersetzung ist weniger bevorzugt und erfordert höhere Temperaturen (1380-1400 ° C). In MGCO -Fällen3, Dieb3 und SRCO3, Sie brechen bei niedrigeren Temperaturen zusammen.
Kann Ihnen dienen: Magnesium: Geschichte, Struktur, Eigenschaften, Reaktionen, verwendetChemische Struktur
Der Anion co32- Es hat eine Doppelbindung, die zwischen drei Sauerstoffatomen Resonanz ist, zwei davon negativ, um das Kation BA anzulocken2+.
Während beide Ionen als geladene Kugeln angesehen werden können, ist der CO32- Es hat eine flache trigonale Geometrie (das von den drei Sauerstoffatomen gezogene flache Dreieck), das möglicherweise ein negativer "Pad" für den BA ist2+.
Diese Ionen interagieren elektrostatisch, um eine kristalline Anordnung eines ortorrhrombischen Typs zu bilden. Dies ist die überwiegend ionischen Bindungen.
In diesem Fall ist der Bacchus nicht löslich?3 Im Wasser? Die Erklärung basiert einfach auf der Tatsache, dass Ionen im kristallinen Netzwerk besser stabilisiert sind als durch sphärische molekulare Wasserschichten hydratisiert.
Aus einem anderen Blickwinkel erschweren Wassermoleküle es schwierig, starke elektrostatische Anziehungen zwischen den beiden Ionen zu überwinden. Innerhalb dieser kristallinen Netzwerke können sie Verunreinigungen beherbergen, die ihren weißen Kristallen Farbe verleihen.
Anwendungen
Auf den ersten Blick ein Bacchus -Teil3 Es kann keine praktische Anwendung im täglichen Leben versprechen, aber wenn es einen Kristall des Whiterite -Minerals gibt, der weiß wie Milch ist, beginnt er sinnvoll zu sein, warum seine wirtschaftliche Nachfrage.
Wird verwendet, um Bariumglas herzustellen oder als Zusatz, sie zu stärken. Es wird auch zur Herstellung von optischem Glas verwendet.
Aufgrund seines großartigen Netzwerks und seiner unlöslichen Enthalpie wird es zur Herstellung verschiedener Arten von Legierungen, Gummi, Ventilen, Böden von Böden, Gemälden, Keramik, Schmierstoff, Kunststoffen, Fetten und Zementen verwendet.
Es wird auch als Gift für Mäuse verwendet. Zusammenfassend wird dieses Salz verwendet, um andere Bariumverbindungen herzustellen und somit als Materialien für elektronische Geräte dienen.
Kann Ihnen dienen: Sulfanylsäure: Struktur, Eigenschaften, Synthese, verwendetDer Bacchus3 Es kann als Nanopartikel synthetisiert werden, die sehr kleine Skalen neue interessante Eigenschaften von Whiterit ausdrücken. Diese Nanopartikel werden verwendet, um Metalloberflächen, insbesondere chemische Katalysatoren.
Es wurde festgestellt.
Sie werden als Geräte angesehen, um die Prozesse zu beschleunigen, in denen Sauerstoff eingebaut werden. Und schließlich werden sie verwendet, um supramolekulare Materialien zu synthetisieren.
Risiken
Der Bacchus3 Es ist giftig aufgrund der Aufnahme, was zu unangenehmen Symptomen führt, die zum Tod aufgrund von Atemversagen oder einem Herzstillstand führen. Aus diesem Grund wird nicht empfohlen, neben essbaren Waren transportiert zu werden.
Es erzeugt Rötungen der Augen und Haut, zusätzlich zu Husten und Halsschmerzen. Es ist eine giftige Verbindung, obwohl sie leicht mit nackten Händen manipulierbar ist, wenn ihre Einnahme um jeden Preis vermieden wird.
Es ist nicht brennbar, aber bei hohen Temperaturen bricht es zusammen, um Bao und Co zu bilden2, Giftige und oxidierende Produkte, mit denen andere Materialien brennen lassen können.
Im Organismus wird Barium in Knochen und anderen Geweben abgelagert, wodurch Kalzium in vielen physiologischen Prozessen erzeugt wird. Es blockiert auch die Kanäle, in denen die K -Ionen reisen+, Verhinderung seiner Diffusion durch Zellmembranen.
Verweise
- Pubchem. (2018). Bariumcarbonat. Abgerufen am 24. März 2018 aus Pubchem: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2017). Bariumcarbonat. Abgerufen am 24. März 2018 aus Wikipedia: in.Wikipedia.Org
- Chemikalbuch. (2017). Bariumcarbonat. Abgerufen am 24. März 2018 aus Chemicalbook: Chemicalbook.com
- Robbins Manuel a. (1983).Robbins Das Sammlerbuch der fluoreszierenden Mineralien. Fluoreszenzmineralien Beschreibung, P-117.
- Shiver & Atkins. (2008). Anorganische Chemie. In Die Struktur einfacher Feststoffe (vierte Edition., P. 99-102). Mc Graw Hill.