Calciumcarbonatstruktur, Eigenschaften, Bildung, verwendet

- 2553
- 52
- Rieke Scheer
Er Kalziumkarbonat Es ist eine anorganische Verbindung, deren chemische Formel Caco ist3. Es ist hauptsächlich in Mineralien wie Calcit und Aragonit vorhanden. Ebenso ist der Kalkstein komponiert, ein Sedimentgestein, in dem das Calcita -Mineral vorhanden ist.
Dieses wichtige Metallcarbonat wird industriell durch Extraktion und Mahlen der Mineralien erhalten, die es enthalten. Zu diesem Zweck wird Marmor hauptsächlich verwendet. Ein weiteres Verfahren liegt in der Verwendung von Calciumoxid, das Calciumhydroxid wird, wodurch Calciumcarbonat durch Zugabe von Kohlendioxid ausgelöst wird. Auf diese Weise werden Kristalle aus einer Vielzahl von Größen erhalten.
 Die Schneckenhülle besteht hauptsächlich aus Calciumcarbonat. Quelle: Pixabay.
Die Schneckenhülle besteht hauptsächlich aus Calciumcarbonat. Quelle: Pixabay. Sie können auch für die Caco -Industrieproduktion verwendet werden3, In kleinem Maßstab die Muscheln der Muscheln, die Eierschalen und die Austernschalen, in denen sie vorhanden ist.
Der im Kalkstein vorhandene Kalziumcarbonat wird durch Kohlendioxid in Wasser gelöst, wodurch Calciumbicarbonat erzeugt wird. Diese Aktion kann die Höhlen verursachen und ist eine Ursache für die Alkalinierung von Wasser; Ereignis von großer Bedeutung für die Aufrechterhaltung des Lebens darin.
Es wurde für den Bau und die Ausarbeitung von Skulpturen verwendet; Beispiele hierfür sind der Partner von Athen, die Kathedrale von Krakau und die Skulptur von Abraham Lincoln in Washington. Die Anfälligkeit für sauren Regen hat jedoch die Verwendung bei der Konstruktion verringert.
Calciumcarbonat hatte mehrere Anwendungen in der Branche als Kunststoff- und Papierfüllmaterial. In der Medizin wurde es verwendet, um den Magensäure zu kontrollieren; als Kalziumergänzung; Phosphatie bei Patienten mit chronischem Nierenversagen usw. zu kontrollieren, usw.
[TOC]
Struktur
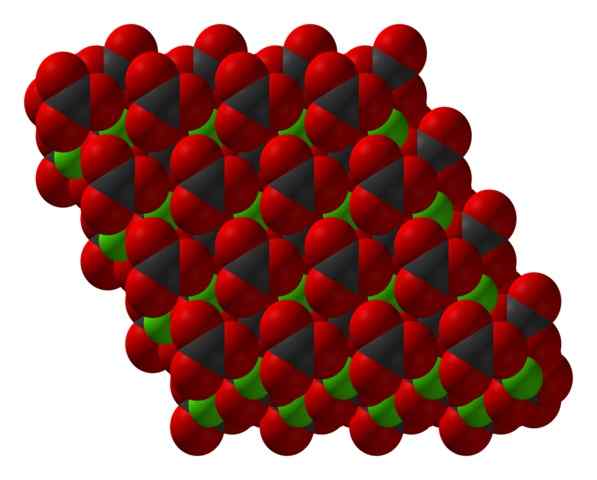 Chanco3 Kristalline Struktur mit einem Raumfüllmodell dargestellt. Quelle: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Chanco3 Kristalline Struktur mit einem Raumfüllmodell dargestellt. Quelle: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Die Calciumcarbonatformel Caco3, zeigt an, dass der Anteil zwischen CA -Ionen2+ und co32- Es ist 1: 1; Das heißt für jede CA2+ Es gibt einen CO32- Gegenstück, die Electrostátical mit ihm interagieren. Somit hat die ionische Bindung diese Ionen, um strukturelle Muster zu bilden, die einen Kristall definieren.
Im überlegenen Bild wird die Struktur des Kakos gezeigt3. Grüne Kugeln entsprechen den Ca -Kationen2+, und die roten und schwarzen Kugeln zu den Co -Anionen32-. Beachten Sie, dass die Struktur durch mehrere Schichten gebildet zu sein scheint: eines von Calcium und einer von Carbonat; was bedeutet, dass es in einer kompakten hexagonalen Struktur kristallisiert.
Es kann Ihnen dienen: Ammoniumchlorid (NH4CL)Diese hexagonale Phase (β-Caco3) Entspricht einem Polymorph. Es gibt zwei andere: ortorrombisch (λ-Caco3) und eine noch dichteste sechseckige (μ-Caco3). Das untere Bild hilft, das glückliche Sechseck besser zu visualisieren:
 Sechseckige Struktur von Calcit. MATERIALSCHIENSISTER AT ENGLISH WIKIPEDIA [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Sechseckige Struktur von Calcit. MATERIALSCHIENSISTER AT ENGLISH WIKIPEDIA [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Abhängig von der Temperatur (und für diesen Salz der Druck) werden die Ionen in ihren Schwingungen jedoch an andere Strukturen angepasst; Dies sind die oben genannten Polymorphen (β, λ und μ).
Da sie klingen, sind nicht bekannt, es sei denn, sie werden in einem nächsten Abschnitt mit ihren mineralogischen Namen erwähnt.
Proteinhärte
Cacos Kristalle3 Sie sind nicht allein: Sie können Verunreinigungen wie andere Metallkationen veranstalten, die sie in Farben färben; o Proteine, die eine organische Matrix einbeziehen, die irgendwie zu ihrer natürlichen Härte beiträgt.
Proteine verringern die Spannung, die von Kristallen voneinander vor einem Druck oder Auswirkungen auftritt. Als? Beim Einsetzen zwischen den Kristallen, als wäre es ein "Pad" (ähnlich der Ziegelzement-Lady), als wäre es ein "Pad").
Deshalb ist diese Verbindung oder dieses Mineral biokompatibel und es ist nicht überrascht, dass sie Teil der Nägel, Meeresschalen, Muscheln oder Knochen der Igel ist. Es war eine Inspirationsquelle für diejenigen, die sich der Entwicklung neuer Materialien widmen.
Eigenschaften
Andere Namen
-Aragonit
-Calcito
-Volterit
-Kalziummilch
-Whiteboard
-Marmor
Molmasse
100.086 g/mol.
Physische Beschreibung
Weiße Staub Toilette.
Geschmack
Ähnlich wie Kreide, geschmacklos.
Fusion und Siedepunkte
Es bricht zusammen, weil es Co freigibt2 Bevor Sie überhaupt schmelzen oder kochen.
Löslichkeit
Praktisch unlöslich in Wasser und Alkohol. Es wird mit Sprudeln in verdünnten Essigsäure und Salzsäuren gelöst. Hydroxide reduzieren jedoch ihre Löslichkeit. Inzwischen erhöhen Ammoniumsalze und Kohlendioxid die Löslichkeit von Calciumcarbonat in Wasser.
Dichte
2,7 bis 2,95 g/cm3.
Zersetzung
Um 825 ° C wird in Calciumoxid (Kalk) und Kohlendioxid (CO) unterteilt2).
pH
8 bis 9
Brechungsindex
-1.7216 bis 300 nm und 1.6584 bis 589 nm (Calcita).
-1.5145 bis 300 nm und 1.4864 bis 589 nm (Aragonit).
Inkompatibilitäten
Mit Säuren, Aluminium und Ammoniumsalzen.
Fusion Enthalpy
36 kJ/mol bei 800 ºC (Calcit).
Kann Ihnen dienen: Molarität: Konzentration, Einheiten, Berechnung, ÜbungenLöslichkeitsproduktkonstante
3.36 · 10-9 bei 25 ºC.
Härte
-3.0 (Calcit)
-3,5 - 4.0 (Aragonit) auf der MOHS -Skala.
Phasenübergänge
Der Aragonit ist metastabil und wechselt irreversibel, um ihn in trockener Luft auf 400 ºC zu erwärmen.
Reaktivität
Calciumcarbonat reagiert mit Säuren, Freisetzung von Kohlendioxid, ionischem Kalzium und Wasser.
Calciumcarbonat wird mit gesättigtem Wasser mit Kohlendioxid kombiniert, entspricht Kohlensäure (H2CO3), Um Kalziumbicarbonat zu bilden.
Ausbildung
Die Kreide, Marmor und Kalkstein, die ersten beiden Mineralien und ein felsiges Material im dritten, enthalten Calciumcarbonat und sind von sedimentärer Ursprung. Es wird angenommen, dass sie durch die Sedimentation von Schnecken seit Millionen von Jahren gebildet werden.
Der pH -Wert könnte der wichtigste Faktor bei der Bildung von Polymorphen bei einer Temperatur von 24 ° C sein. Die Vaterita ist das Hauptprodukt in einem pH -Bereich zwischen 8,5 und 10; Aragonit ist pH 11; und der Calcit zu pH> 12.
Es ist auch bekannt. Darüber hinaus können Mikroalgen Calciumcarbonatausfälle verursachen.
Calciumcarbonatformen
In den folgenden Bildern werden die drei Hauptformen oder Polymorphen für Calciumcarbonat angezeigt:
 Calcita Crystal. Quelle: Eltern Géry [Public Domain]
Calcita Crystal. Quelle: Eltern Géry [Public Domain] Aragonitkristall. Quelle: Battistini Riccardo [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Aragonitkristall. Quelle: Battistini Riccardo [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Vaterita -Kristalle. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Vaterita -Kristalle. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Von oben nach unten sind die Calcit-, Aragonit- und Vaterita -Polymorphen. Beachten Sie den Unterschied zwischen der Morphologie ihrer Kristalle (die Farbe ist typisch für ihre Ursprünge und Eigenschaften ihrer Umgebungen).
Die Vaterita ist undurchsichtiger als der Calcit, wobei letztere sogar vollständig werden. Inzwischen ähneln die Aragonitkristalle kleine, längliche Monolithen.
Wenn unter dem elektronischen Mikroskop Proben dieser drei Polymorphen beobachtet werden, werden die gleichen Morphologien wie in makroskopischen Skalen gefunden. Das ist auf den ersten Blick.
Unter diesen drei Polymorphen ist der Calcit der häufigste und stabilste, gefolgt vom Aragonit und schließlich der Vaterita, der seltensten der Formen des Caco3
Kann Ihnen dienen: Kalorimetrie: Welche Studien und AnwendungenAnwendungen
Industrielle
Calciumcarbonat erhöht die Resistenz gegen Torsion und Traktion von Synthetik und Naturkautschuk und erhält seine Flexibilität. Es wird in der Bauindustrie als Zementzutat und als Rohstoff für Kalk verwendet. Die Verwendung wurde verringert, weil es durch sauren Regen beschädigt wird.
Calciumcarbonat wird bei der Eisenreinigung verwendet. In Form von Kalk eliminiert das im Metall vorhandene Schwefeldioxid. Rübenzuckerreinigung wird verwendet. Es wurde als Kreide für Schiefer verwendet, wurde jedoch für diese Anwendung durch den Gips ersetzt.
Calciumcarbonat wird mit dem Kitt gemischt, der bei der Platzierung von Glas verwendet wird. Der Boden wird als Füllmaterial in dem in Windeln verwendeten mikroporösen Film verwendet. Es wird auch als Füllmaterial in Kunststoffen wie PVC verwendet. Darüber hinaus nimmt die Stärke von Plastik zu.
Calciumcarbonat wird verwendet, um die Abdeckungskapazität der Gemälde zu erhöhen. Es wird als Papierfüllmaterial verwendet, da es billiger ist als Holzfaser und mehr als 10% des Papiers darstellen können.
Ärzte
Es wird als Antazida verwendet. Es wird als Kalziumergänzung sowie bei der Behandlung und Vorbeugung von Osteoporose verwendet. Es wird bei der Behandlung von Hyperphosphatie bei Patienten mit chronischem Nierenversagen verwendet.
Es wurde verwendet, um die unerwünschten Wirkungen von Protease -Inhibitoren zu verringern.
Es führt zu einer Verringerung des Blutdrucks bei schwangeren Frauen mit Bluthochdruck und Präeklampsie.
Andere
Calciumcarbonat wird in der Landwirtschaft als Dünger und zur Bekämpfung der Säure des Bodens verwendet. Es wird als Konservierungsmittel-, Farbhalter- und Lebensmittel verwendet.
Darüber hinaus ist es ein Zahnpasta -Zutat und dient beim Reinigen und Waschen als abrasiv.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Carbonat Calcium. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Carbonat Calcium. Pubchem -Datenbank., CID = 10112. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Kai-yin Chong, Chin-Hua Chia und Sarani Zakaria. (2014). Polymorphs Calciumcarbonat bei der Temperaturreaktion. AIP Conference Proceedings 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1. November 2016). Entdecken Sie Howum -Carbonat -Kristalle erhalten Festigkeit. Vorteilsgeschäftsmarketing. Erholt von: rdmag.com
- Amerikanische Elemente. (2019). Carbonat Calcium. Abgerufen von: Amerikanerungen.com
- Elsevier. (2019). Carbonat Calcium. Scientedirect. Abgerufen von: Scientedirect.com
- Chemisches Buch. (2017). Carbonat Calcium. Erholt von: Chemicalbook.com

