Lithiumcarbonat (LI2CO3) -Struktur, Eigenschaften, verwendet

- 4768
- 1371
- Luca Holdt
Er Lithiumcarbonat Es ist ein anorganischer Feststoff, der von zwei Lithium li gebildet wird+ und ein Carbonatanion co32-. Seine chemische Formel ist li2CO3. Das li2CO3 Es ist ein weißer kristalline Feststoff, der durch die Reaktion zwischen Lithiumhydroxid und Kohlendioxid erhalten werden kann.
Lithiumcarbonat hat einen sehr hohen Fusionspunkt, daher wird es bei der Zubereitung von Glas, Keramik und Porzellan verwendet. Es hat sehr unterschiedliche Verwendungen wie wiederaufladbare Lithiumbatterien bei der Herstellung anderer Lithiumverbindungen, Schweißelektroden und in Gemälden und Lacken.
 Lithiumcarbonat Li2CO3 solide. Bild von W: Benutzer: Walkerma im Juni 2005. Quelle: Wikimedia Commons.
Lithiumcarbonat Li2CO3 solide. Bild von W: Benutzer: Walkerma im Juni 2005. Quelle: Wikimedia Commons. Li wird auch verwendet2CO3 In Zementmischungen, um eine schnelle Einstellung und Aluminiumproduktion zu erzielen.
Eine der wichtigsten Verwendungen ist die Behandlung einiger psychischer Erkrankungen wie Depressionen und übermäßig aggressives Verhalten unter anderem.
Die Verwendung als Medizin muss jedoch von medizinischen Spezialisten ordnungsgemäß kontrolliert werden, weil Menschen mit Li behandelt werden2CO3 Sie können schädliche Auswirkungen auf die Gesundheit haben, wie z. B. Hypothyreose (reduzierte Funktion der Schilddrüse).
[TOC]
Struktur
Lithiumcarbonat besteht aus zwei Lithium li+ und ein Carbonatanion co32-.
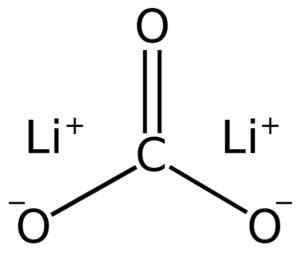 Lii lithium carbonatstruktur2CO3. Adrian Hands [Public Domain]. Quelle: Wikimedia Commons.
Lii lithium carbonatstruktur2CO3. Adrian Hands [Public Domain]. Quelle: Wikimedia Commons. Elektronische Lithiumkonfiguration im Oxidationszustand +1 beträgt 1s2 2s0, Nun, er hat das Elektron der letzten Schicht verloren und so stabiler ist. Das Carbonat Ion Co32- Es hat eine flache Struktur.
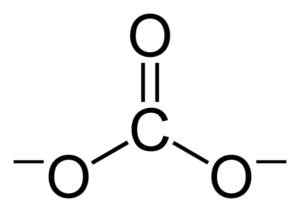 Flache Struktur des Kohle -Ionen -CO32-. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Flache Struktur des Kohle -Ionen -CO32-. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Negative Belastungen werden gleichermaßen unter den drei Sauerstoffatomen des Kohle -Ionen -CO verteilt32-.
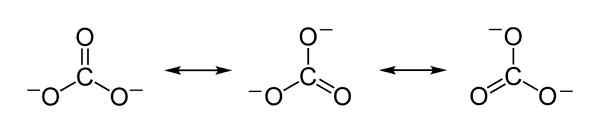 Theoretische Resonanzstrukturen des Carbonat -Ion -CO32- die dazu dienen, die gerechte Verteilung negativer Lasten zwischen den 3 Sauerstoffatomen zu erklären. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Theoretische Resonanzstrukturen des Carbonat -Ion -CO32- die dazu dienen, die gerechte Verteilung negativer Lasten zwischen den 3 Sauerstoffatomen zu erklären. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
-Lithiumcarbonat
-Dilitio Carbonat
Physikalische Eigenschaften
Körperlicher Status
Kristalliner weißer Feststoff der monokline Struktur
Molekulargewicht
73,9 g/mol
Schmelzpunkt
723 ºC
Zersetzung
Es zersetzt sich bei 1300 ° C.
Dichte
2,11 g/cm3
Löslichkeit
Wenig löslich im Wasser: 1,31 % von Gewicht bei 20 ºC. Seine Wasserlöslichkeit nimmt mit zunehmender Temperatur ab. Es ist löslich in verdünnten Säuren. Es ist unlöslich in Alkohol und Aceton.
Kann Ihnen dienen: Bariumoxid (BAO): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenpH
Wasserlösungen sind alkalisch, sie haben einen pH -Wert von mehr als 7.
Chemische Eigenschaften
Das li2CO3 Es ist in wässriger Lösung hydrolysiert, die eine grundlegende Lösung erzeugt. Der geringe Anteil der in Wasser lösisierten Verbindung verlässt das Carbonatanion -Co -freie32-.
Das Carbonatanion Co32- Frei in wässriger Lösung nimmt ein Proton, um den HCO -Bicarbonat -Anion zu bilden3-, Wie in der folgenden Reaktion zu sehen ist:
CO32- + H2O → HCO3- + Oh-
Die Anwesenheit von OH -Ionen- Es ist das, was die Lösung grundlegend macht.
Biologische Eigenschaften
In tierischen und menschlichen Geweben gibt es normalerweise Lithium -Drehspuren, aber bis zum Moment ist keine natürliche physiologische Rolle dieses Ions bekannt.
Im menschlichen Organismus das li2CO3 Als Medikamente eingenommen, wirkt auf eine Vielzahl von Signalmechanismen in Neuronen und anderen Zellen. Dies ergibt sich aus dem Austausch von Kationen wie Natrium und Kalium.
Der Einbau des Lithiumions in die Struktur der Zellmembran kann die Reaktion auf Hormone und Zellkopplung mit Energieprozessen verändern.
Auf diese Weise modifiziert Lithium mehrere zelluläre Prozesse, einschließlich des Stoffwechsels.
Durch die Modifikation der Art und Weise, wie die Zellen funktionieren2CO3 Sie können auf die Kommunikationsmechanismen von Neuronen im Gehirn reagieren.
Erhalten
Das li2CO3 Es kann durch die Lithiumhydroxid -Reaktion mit Kohlendioxid CO erhalten werden2, Wie nachfolgend dargestellt:
2 lioh + co2 → Li2CO3 + H2ENTWEDER
Kommerziell aus Mineralien, die Lithium wie Spodumen und Lepidolith enthalten. Diese Mineralien werden bei hohen Temperaturen mit bestimmten Sulfatsalzen oder mit alkalischen Verbindungen behandelt, um Lithiumsalze zu erhalten.
Die erhaltenen Lithiumsalze werden mit Wasser- oder Säurelösungen gereinigt und dann mit Carbonaten behandelt, um Li zu bilden2CO3.
Allerdings der Li2CO3 auf diese Weise erreicht wird mit Sulfaten oder Calciumchloriden, Magnesium, Eisen, Natrium, Kalium usw. kontaminiert. Erfordern Sie also eine anschließende Reinigung.
Anwendungen
Bei der Behandlung von psychischen Erkrankungen
Es wird als Antidepressivum gegen Antimanan, bei der Behandlung von aggressiven impulsiven Verhaltensweisen und bei bipolaren Störungen (Menschen, die ihren Humor plötzlich ohne Ursache ändern, gewalttätig werden (Menschen, die ihren Humor plötzlich ändern).
Kann Ihnen dienen: 20 Beispiele für chemische Sublimation und Eigenschaften Einige aggressiv-impulsive Störungen können mit Li behandelt werden2CO3. Autor: Prawny. Quelle: Pixabay.
Einige aggressiv-impulsive Störungen können mit Li behandelt werden2CO3. Autor: Prawny. Quelle: Pixabay. Ärzte haben beobachtet, dass ihre Verabreichung zu einer Abnahme der Intensität und Häufigkeit schwerer Perioden von Depressionen und manischen Episoden führt.
Es wird allein verwendet, dh ohne zusätzliche Verbindung in der Erhaltungstherapie der unipolaren Depression und bei schizoökifischen Störungen. Es dient auch dazu, die antidepressive Wirkung anderer Medikamente zu erhöhen.
Obwohl es verwendet wurde, um Kinder mit offensichtlichen Symptomen einer bipolaren Störung und Hyperaktivität mit neurotischen oder aggressiven Komponenten zu behandeln, war es in allen Fällen nicht wirksam.
Bei der Behandlung von Symptomen anderer Krankheiten
Es wird verwendet, um die Häufigkeit starker Kopfschmerzen zu verringern, wiederkehrend und chronisch.
Es wird verwendet, um die Inzidenz von Infektionen bei Patienten mit Chemotherapie induzierte Neutropenie oder andere Gründe zu verringern. Neutropenie ist die Abnahme von Neutrophilen, eine Art weiße Blutkörperchen, die dazu beitragen, Infektionen im Körper zu bekämpfen.
Es wurde als Schilddrüsenenzym -Inhibitor zur Behandlung von Hyperthyreose verwendet, aber es ist keine bevorzugte Behandlung aufgrund seiner nachteiligen Wirkungen.
Form der Verwaltung
Es wird in Form von Li -Tabletten oder Kapseln verwendet2CO3. Auch in langsamen Tabletten mit Lithiumcitrat. Li ist bevorzugt2CO3 Weil es beim Schlucken den Hals nicht irritiert, wie es mit anderen Lithiumsalzen passiert.
 Autor: Pete Lyforth. Quelle: Pixabay.
Autor: Pete Lyforth. Quelle: Pixabay. Nebenwirkungen
Das li2CO3 Es kann sich schädlich auf Schilddrüse und Nieren auswirken, sodass die Funktion dieser Organe vor und während der Behandlung mit dieser Verbindung überwacht werden muss.
Das li2CO3 Es kann in Konzentrationen toxisch sein, die sehr nahe an den in medizinischen Behandlungen beschäftigt sind.
Li -Vergiftungssymptome2CO3 Sie sind Zittern, Muskelkrämpfe, Muskelschwäche, Durchfall, Erbrechen, Schläfrigkeit oder Ataxie (Verschlechterung der Muskelkoordination) unter anderem.
Zu Beginn der Lirapie2CO3 Symptome wie Zittern, Kopfschmerzen und Übelkeit können ebenfalls auftreten. Diese verschwinden jedoch tendenziell durch fortgesetzte Medikamente.
Kann Ihnen dienen: HolmioDie meisten behandelten Menschen können auch Leukozytose entwickeln (Anstieg der Anzahl der weißen Blutkörperchen), aber dies ist reversibel.
Menschen, die mit Li medikamentiert werden2CO3 Sie sollten keine Fahrzeuge bewältigen oder Maschinen betreiben.
Fälle, in denen es nicht verabreicht werden sollte
Es sollte bei Kindern unter 12 Jahren nicht verwendet werden, da es die Bildung von Knochen und ihre Dichte beeinträchtigen kann, da es die Konzentrationen eines Schilddrüsenhormons verändert. Es neigt auch dazu, den Kalziumort in den Knochen zu besetzen.
Sie sollten nicht mit Li behandelt werden2CO3 Menschen mit Herz -Kreislauf -Erkrankungen, Nieren oder Schilddrüsen. Noch bei stark dehydrierten Patienten.
Schwangere sollten nicht insbesondere während des ersten Schwangerschaftstrimesters verabreicht werden. Lithium kreuzt die Plazenta und kann den Fötus leicht mit möglichen teratogenen Effekten erreichen, dh es kann Anomalien oder Missbildungen im Brauen des Babys erzeugen.
Ältere Menschen, die eine Behandlung mit Li benötigen2CO3 Sie sollten mit großer Sorgfalt und mit niedrigeren Dosen behandelt werden als junge Erwachsene, da sie eine Hypothyreose -Krankheit entwickeln können.
Andere Verwendungen
Das li2CO3 Hohe Reinheit wird häufig bei der Herstellung von Lithium -wiederaufladbaren Batterien verwendet.
Es wird in geschmolzenen Carbonat -Brennstoffzellen verwendet.
Es wird zur Herstellung von elektrischem Porzellan verwendet. Es wird auch zur Herstellung von Verglasung auf Keramik verwendet.
 Das li2CO3 Es wird verwendet, um elektrisches Porzellan zuzubereiten, das als Elektrizitätsisolator verwendet wird, beispielsweise in elektrischen Strompfosten. FIR0002 Flagstoffotos [at] Google Mail.com Canon 20d + Tamron 28-75 mm 1: 2.8 [GFDL 1.2 (http: // www.Gnu.Org/lizenzen/alte Lizenzen/FDL-1.2.html)]. Quelle: Wikimedia Commons.
Das li2CO3 Es wird verwendet, um elektrisches Porzellan zuzubereiten, das als Elektrizitätsisolator verwendet wird, beispielsweise in elektrischen Strompfosten. FIR0002 Flagstoffotos [at] Google Mail.com Canon 20d + Tamron 28-75 mm 1: 2.8 [GFDL 1.2 (http: // www.Gnu.Org/lizenzen/alte Lizenzen/FDL-1.2.html)]. Quelle: Wikimedia Commons. Es ermöglicht die Vorbereitung von Keramik mit niedrigem Ausdehnungskoeffizienten, dh, dass es sich beim Erhöhen der Temperatur nur sehr wenig ausdehnt, sodass die Keramik in einem höheren Temperaturintervall verwendet werden kann.
Andere seiner Verwendungen sind als Katalysator bei der Herstellung anderer Lithiumverbindungen wie Schweißelektroden, in Lumineszenzfarbenformeln, Läcken und Farbstoffen sowie in der elektrolytischen Aluminiumproduktion.
Es ist nützlich, um eine schnellere Zementeinstellung zu erzeugen, und fügt den Fliesenkleber hinzu, damit sie in kurzer Zeit repariert werden können.
 Autor: Capri23auto. Quelle: Pixabay.
Autor: Capri23auto. Quelle: Pixabay. Verweise
- Cai, w. et al. (2018). Entfernung von SO42- von li2CO3 durch Rekristallisation in NA2CO3. Crystals 2018, 8, 19. MDPI erholt sich.com.
- Gadikota, g. (2017). Verbinden Sie die morphologischen und kristallstrukturellen Veränderungen während der Umwandlung von Lithiumhydroxidmonohydrat in Lithiumcarbonat unter Verwendung von Multi-Skala-Röntgenstreuungsmessungen. Mineralien 2017, 7, 169. MDPI erholt sich.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Lithiumcarbonat. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Söhne.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. VCH Verlagsgellschaft MBH.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- « Beispiele für interne und externe konjugierte Winkel, Übungen, Übungen
- .Stearinsäure (CH3 (CH2) 16COOH) Struktur, Eigenschaften, verwendet, verwendet »

