Kaliumcarbonat (K2CO3) -Struktur, Eigenschaften, Verwendungen, erhalten

- 4029
- 1148
- Medine Kedzierski
Er Kaliumcarbonat Es ist eine anorganische Verbindung, die von zwei Kaliumionen k gebildet wird K+ und ein Kohle -Ion -Co32-. Seine chemische Formel ist k2CO3. Es ist ein hygroskopischer weißer Feststoff, dh es absorbiert das Wasser leicht aus der Umwelt. Daher wird es in Labors verwendet, um Wasser aus anderen Substanzen zu absorbieren.
Es ist sehr löslich in wasserbildenden alkalischen Lösungen, die reich an OH -Ionen sind-und damit mit einem hohen pH -Wert. Seine wässrigen Lösungen, da sie alkalisch sind2 und Wasserstoffsulfid H2S, dann leicht zu neutralisiert sie.
 Kaliumcarbonat k2CO3 solide. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons.
Kaliumcarbonat k2CO3 solide. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons. Das K2CO3 Es wird verwendet, um Seifen, Reinigungsprodukte, Waschmittel zum Waschen von Kleidung und Mischungen zum Waschen von Geschirr zuzubereiten. Es wird auch bei der Verarbeitung einiger Textilfasern wie Wolle verwendet.
Es wird in Chemielabors häufig verwendet, z.
Einige Lebensmittel werden zum Beispiel auch hinzugefügt, um den bitteren Geschmack von Kakaosamen während der Schokoladenproduktion zu beseitigen.
[TOC]
Struktur
Kaliumcarbonat besteht aus zwei Kaliumk -Kationen+ und ein Carbonatanion co32-. Das Carbonatanion hat eine flache und symmetrische Struktur, während die drei Sauerstoffatome Kohlenstoff umgeben und ein flaches Dreieck bilden.
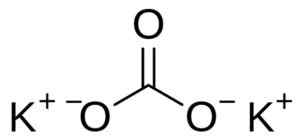 Kaliumcarbonatstruktur k2CO3. Benutzer: Edgar181 [Public Domain]. Quelle: Wikimedia Commons.
Kaliumcarbonatstruktur k2CO3. Benutzer: Edgar181 [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
- Kaliumcarbonat
- Kaliumcarbonat
- Dipotasiumcarbonat
- Pottasche
- Kohlensäure -Kaliumsalz.
Eigenschaften
Körperlicher Status
Kristalline Feste farblos zu Weiß.
Molekulargewicht
138.205 g/mol.
Schmelzpunkt
899 ºC.
Siedepunkt
Es zersetzt sich.
Dichte
2,29 g/cm3
Löslichkeit
Sehr löslich in Wasser: 111 g/100 g Wasser bei 25 ° C. Unlöslich in Ethanol und Aceton.
Kann Ihnen dienen: Beiträge von Chemie zur MedizinpH
Eine wässrige Lösung kann einen pH -Wert von 11,6 haben, dh sie ist ziemlich alkalisch.
Chemische Eigenschaften
Kaliumcarbonat ist zart oder hygroskopisch, dh es absorbiert die Luftfeuchtigkeit der Umwelt. Es hat ein stabiles Hydrat, das k2CO3.2H2ENTWEDER.
Das K2CO3 In wässriger Lösung wird es hydrolysiert, dh es reagiert mit dem Wasser, indem es OH -Gruppen freigibt- Welches sind diejenigen, die den Lösungen Alkalität verleihen:
CO32- + H2Oder ⇔ oh- + HCO3-
HCO3- + H2Oder ⇔ oh- + H2CO3
Erhalten
Kann aus der verbleibenden Asche beim Verbrennen von Pflanzen erhalten werden. Auch durch Kohlensäure des Koh -Kaliumhydroxids, das heißt, überschüssige Kohlendioxid -CO hinzugefügt2 Nach Koh:
Koh + co2 → khco3
2 khco3 + Hitze → k2CO3 + H2ENTWEDER
Eine andere Möglichkeit, es zu erhalten, ist das Erhitzen des KCL -Kaliumchlorids mit Magnesiumcarbonat3, Wasser und co2 unter Druck. Zuerst wird ein doppelt hydratisiertes Magnesium und Kaliumsalz und Kalium erhalten3.Khco3.4H2Oder, Engelsalz:
2 kcl + 3 mgco3 + CO2 + 5 h2O → Mgco3.Khco3.4H2Oder ↓ + mgcl2
Das doppelte hydratisierte Salz von Engelsfällen fällt aus und trennt sich durch Filtration von der Lösung. Dann wird das Kaliumcarcarbonat erhitzt und gebildet2CO3 das durch Zugabe von Wasser löst sich auf, während Mgco Magnesiumcarbonat3 bleibt unlöslich und durch Filtration beseitigt.
MGCO3.Khco3.4H2O + Wärme → Mgco3↓ + 2 k+ + CO32- + CO2↑ + 9 h2ENTWEDER
Anwendungen
In der Absorption von CO2 In industriellen Prozessen
Kaliumcarbonatlösung ist die klassische Behandlung zur Kohlendioxidentfernung CO2 In verschiedenen Prozessen, insbesondere bei hohen Drücken und Temperaturanwendungen.
 K -Lösungen2CO3 Sie werden verwendet, um CO zu absorbieren2 In verschiedenen industriellen Prozessen. Autor: Nicola Giordano. Quelle: Pixabay.
K -Lösungen2CO3 Sie werden verwendet, um CO zu absorbieren2 In verschiedenen industriellen Prozessen. Autor: Nicola Giordano. Quelle: Pixabay. Die Entfernung von CO2 tritt gemäß der folgenden Reaktion auf:
K2CO3 + CO2 + H2Oder ⇔ 2 khco3
Diese Methode wird zum Beispiel zur Behandlung von Erdgas verwendet. Auch in Energieerzeugungsanlagen, um die Emission von CO zu vermeiden2 zur Atmosphäre und in der Produktion von Trockeneis.
Kann Ihnen dienen: Kupferhydroxid (ii): Struktur, Eigenschaften, Nomenklatur, verwendet K -Lösungen2CO3 Sie werden verwendet, um CO zu erhalten2 das dient dazu, Trockeneis zu machen. ProjectManhattan [CC BY-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
K -Lösungen2CO3 Sie werden verwendet, um CO zu erhalten2 das dient dazu, Trockeneis zu machen. ProjectManhattan [CC BY-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. K -Lösung2CO3 Es kann thermisch regeneriert werden, dh aufgrund von Temperaturen, die sich um 100 ° C erwärmen.
Damit die Kaliumcarbonatlösung mit guter Geschwindigkeit CO2 absorbiert, werden Promotoren hinzugefügt, die das Verfahren wie Diadanolamin (DEA) beschleunigen, um zu beschleunigen.
Bei der Entfernung von h2S bestimmter Prozesse
Kaliumcarbonatlösungen werden auch verwendet, um Wasserstoffsulfidgas H zu entfernen2S von Prozessströmen. Manchmal wird Kaliumtiffosphat k zugesetzt3Po4 Um den Prozess schneller zu machen.
In Chemie Laboratorien
Das K2CO3 Ermöglicht die organische Synthese beispielsweise bei Kondensationsreaktionen und neutralisieren. Es dient dazu, Wasser aus organischen Flüssigkeiten zu entfernen, als dehydrierender oder trockenhaftes Mittel im Labor.
Es wird auch in analytischen Chemiereaktionen und zur Alkalisierung in der Pharmaindustrie verwendet.
In der Reinigungsproduktindustrie
Das K2CO3 Es wird zur Herstellung von Seife, Reinigungsformeln, Produkten für Kleidung und Wäsche von Gerichten sowie zur Zubereitung von Shampoo und anderen persönlichen Pflegeprodukten verwendet.
 Das K2CO3 Es wird bei der Seifenvorbereitung verwendet. Lacrosus [Public Domain]. Quelle: Wikimedia Commons.
Das K2CO3 Es wird bei der Seifenvorbereitung verwendet. Lacrosus [Public Domain]. Quelle: Wikimedia Commons. In der Lebensmittelindustrie
Kaliumcarbonat wird mit mehreren Zwecken zu verschiedenen Lebensmitteln zugesetzt.
Zum Beispiel wird es zu Kakaosamen hinzugefügt, um ihren bitteren Geschmack zu beseitigen und in der Schokoladenproduktion zu verwenden. Es wird den Trauben im Trocknungsprozess hinzugefügt, um Raish -Trauben zu erhalten.
 Kakaosamen werden mit K behandelt2CO3 Um seinen bitteren Geschmack bei der Herstellung von Schokolade zu reduzieren. Autor: Magali Couret. Quelle: Pixabay.
Kakaosamen werden mit K behandelt2CO3 Um seinen bitteren Geschmack bei der Herstellung von Schokolade zu reduzieren. Autor: Magali Couret. Quelle: Pixabay. Im Konditorei wird es als Leudant (als Hefe) des Mehls verwendet, um gebackene Lebensmittel zuzubereiten.
Kann Ihnen dienen: Lutecio: Struktur, Eigenschaften, Verwendungen, Erhalten Das K2CO3 Es kann als Ledant in Kuchen verwendet werden, denn wenn es abgibt, co2 Während des Kochens dieses Erhöhungsvolumen. Autor: Pixel1. Quelle: Pixabay.com
Das K2CO3 Es kann als Ledant in Kuchen verwendet werden, denn wenn es abgibt, co2 Während des Kochens dieses Erhöhungsvolumen. Autor: Pixel1. Quelle: Pixabay.com In Düngemitteln
Das K2CO3 Es wird verwendet, um saure Böden zu düngen32- In Kontakt mit Wasser produziert OH -Ionen- das erhöht den pH -Wert des Bodens. Neben Kalium k+ Es ist ein Nährstoff für Pflanzen.
Kaliumcarbonat wurde auch verwendet, um langsame Düngemittel zu machen.
Ein langsamer Düngemittel veröffentlicht oder lose Nährstoffe, damit sie nicht gelöst und von Wasser gezogen werden. Dank dessen können sie mehr Zeit für Pflanzenwurzeln verbringen.
In mehreren Anwendungen
Kaliumcarbonat k2CO3 Es wird auch verwendet für:
- Trocknen, gebleichte und saubere Wollreinigungsprozesse und andere Aktivitäten der Textilindustrie
- Andere organische und anorganische Kaliumsalze wie KCN -Kaliumcyanid erhalten.
- Funktion als Säuregulator in verschiedenen Prozessen.
- Keramik und Keramik machen.
- Gravur- und Lithographieprozesse.
- Bräunen.
- Bereiten Sie Drucktinten, Pigmente vor.
- Manufacce Glas2CO3 Es ist kompatibler als das von Natriumcarbonat na2CO3 Mit Blei, Barium und Strontiumoxiden, die dieses Glas enthalten.
- Wasserversorgung.
- Brand verzögern (in Form von wässrigen Lösungen).
- Korrosion und als Anti-Caring-Agent in Prozessteams hemmen.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Kaliumcarbonat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Steele, d. (1966). Die Chemie der metallischen Elemente. Pergamon Press Ltd. London.
- Mokhatab, s. et al. (2019). Erdgasbehandlung. Die Kaliumcarbonatlösung. Im Handbuch der Erdgasübertragung und -verarbeitung (vierte Ausgabe). Von Scientedirect erholt.com.
- Kakaras, e. et al. (2012). PFBC -Kombinationssysteme für flüssige Bettverbrennung (PFBC). Drucke fließende Bettverbrennung mit Kohlenstoffabdeckung und Lagerung. In kombinierten Zyklussystemen für die Erzeugung von Emissionsstromanlagen in der Nähe von Null. Von Scientedirect erholt.com.
- Speight, j.G. (2019). Wasserstoffproduktion. Nasse Schrubben. Bei schwerer Ölrückgewinnung und -aufbauung. Von Scientedirect erholt.com.
- Branan, c.R. (2005). Gasbehandlung: Kapitel Aktualisiert von Chris Higman. Heißer Carbonatprozess. In Faustregeln für Chemieingenieure (vierte Ausgabe). Von Scientedirect erholt.com.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Söhne.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. VCH Verlagsgellschaft MBH.
- Li, und. und Cheng, f. (2016). Synthese eines neuen Kaliumdüngers mit langsamer Release aus modifiziertem Pidgeon-Magnesiumschlacke durch Kaliumcarbonat. J Air Waste Manag Assoc, 2016 Aug; 66 (8): 758-67. NCBI erholte sich.NLM.NIH.Regierung.
- « Dekantierungskonzept, Beispiele und Typen
- Deutsche Kakerlake -Eigenschaften, Reproduktion, Lebensmittel »

