Natriumcarbonat (Na2co3)
- 2451
- 298
- Frederike Birkemeyer
Wir erklären, was Natriumcarbonat, seine physikalischen und chemischen Eigenschaften, Struktur und Anwendungen sind
 Natriumcarbonatstruktur und Formel
Natriumcarbonatstruktur und Formel Was ist Natriumcarbonat?
Er Natriumcarbonat (N / A2CO3) Es ist ein anorganisches Salz, ein alkalisches Metall und eine Kohlensäure -Säure. Er ist auch weltweit als Sosa Ash bekannt. Seen und vulkanische Aktivitäten bereicherten die Natriumböden, deren Pflanzen genährt wurden; Dann verteilen diese Pflanzen nach einem Feuer die Carbonatasche.
Wie entsteht das metallische Natriumsalz?? Das reine Natrium hat eine Valencia -Konfiguration [NE] 3s1. Das 3S -Orbitalelektron1 Es wird leicht von anderen Elementen der Natur abgelöst (wie Schwefel, Sauerstoff, Chlor, Fluor usw. usw.), Bildung von Mineralverbindungen, an denen das stabile Ion na teilnimmt+.
Dann ein+ Es wird von anderen ionischen Arten in diesen Feststoffen begleitet; Von diesen ist Natriumcarbonat nur ein weiterer in der Natur vorhanden. Seitdem hat es in allen Zivilisationen während der gesamten Zeit verwendet. Diese Zivilisationen stellten sich in diesen gravollen vorteilhaften Eigenschaften für ihre Häuser und Menschen fest.
Diese Eigenschaften markierten ihre Verwendung, die heute traditionelle Aspekte der Vergangenheit beibehalten, und andere erfüllen die aktuellen Bedürfnisse.
Natriumcarbonat ist in der Natur sehr häufig und möglicherweise auch in anderen Gebieten außerhalb des Planeten Erde, wie beispielsweise einige der Monde des Sonnensystems.
Formel
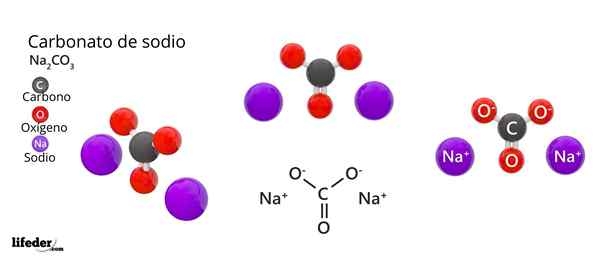
Die chemische Formel von Natriumcarbonat ist na2CO3. Wie wird es interpretiert?? Es bedeutet, dass im kristallinen Feststoff für jede Co -ION32- Es gibt zwei Na -Ionen+.
Natriumcarbonatstruktur
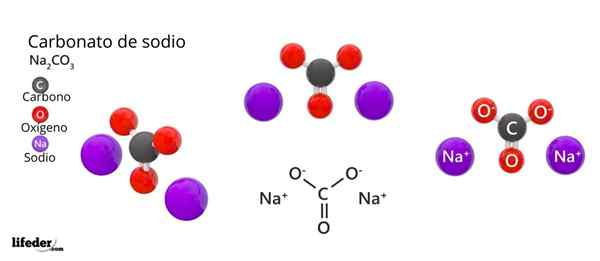
Im oberen Bild wird die Struktur des NA dargestellt2CO3 Anhydrid (auch Sosa Calcinada genannt). Lila Kugeln entsprechen NA -Ionen+, während schwarz und rot zu den Ionen co32-.
Carbonationen haben eine flache trigonale Struktur mit Sauerstoffatomen an ihren Eckpunkten.
Es kann Ihnen dienen: Cinaminsäure: Struktur, Eigenschaften, erhalten, verwendet, verwendetDas Bild gibt ein Panorama aus einer höheren Ebene aus. Na -Ionen+ Sie sind von sechs Sauerstoffatomen umgeben, von Co -ions32-. Das heißt in der na2CO3 Anhydrid Das Natrium trifft auf eine oktaedrische Koordinationsgeometrie (es ist in der Mitte eines Oktaeders eingesperrt).
Diese Struktur kann jedoch auch Wassermoleküle beherbergen und mit Wasserstoffbrücken mit den Eckpunkten der Dreiecke interagieren.
Tatsächlich hydratiert Na2CO3 (N / A2CO3· 10H2Oder na2CO3· 7h2Oder na2CO3· H2Oder und andere) sind von größerer Fülle als anhydrides Salz.
Der Thermonatrit (NA2CO3· H2O) das Natron (NA2CO3· 10H2O) und die Trona (NA3(HCO3) (Co3) · 2h2Oder sind die wichtigsten natürlichen Quellen für Natriumcarbonat, insbesondere das im ersten Bild dargestellte Trona -Mineral.
Verwendet/Anwendungen von Natriumcarbonat
Natriumcarbonat erfüllt zahlreiche Funktionen in Menschen, Haushalten und Industrie, unter diesen Funktionen sticht der folgende heraus:
- Natriumcarbonat wird in zahlreichen Reinigungsprodukten verwendet. Dies liegt an seiner Desinfektionsfähigkeit, der Leistung, Fette aufzulösen, und deren Eigentum, um Wasser zu erweichen. Es ist Teil der Reinigungsmittel, die in Wäsche, automatischer Geschirrspüler, sauberes Glas, Orten rühren, Tribünen usw. verwendet werden.
- Carbonat -Desinfektionsmittel können auf nicht rauten harten Oberflächen wie Böden, Wänden, Porzellan und Badewannen verwendet werden, mit Ausnahme des Glasfaser und Aluminium, das von ihm zerkratzt werden kann.
- Es wird in einigen Lebensmitteln verwendet, um den in diesen auftretenden Tassen zu vermeiden.
- Es ist in mehreren Körperpflegeprodukten wie Blasenbädern, Zahnnudeln und Seifen vorhanden.
- Es wird in der Glasindustrie verwendet, weil es in der Lage ist, Silikate abzubauen.
- Es wird bei der Aufrechterhaltung der Schwimmbäder verwendet, wo es eine Desinfektionsmittel- und Regulierungsfunktion des pH erfüllt.
- Bei Menschen therapeutisch bei der Behandlung von Säure und Dermatitis eingesetzt.
- In der Veterinärmedizin wird es zur Behandlung von Ringwurm und Hautreinigung verwendet.
Natriumcarbonat -Synthese

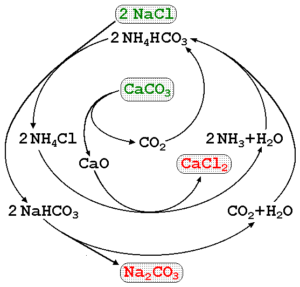
Natriumcarbonat kann unter Verwendung von Sole aus Meeren und Kalkstein (Caco) hergestellt werden3) Im Solvay -Prozess. Im überlegenen Bild wird ein Prozessdiagramm veranschaulicht, der auf die Produktionsrouten sowie auf die Reagenzien, Vermittler und Produkte hinweist. Die Reagenzien sind mit grünen Buchstaben und den Produkten mit roten Buchstaben geschrieben.
Die Überwachung dieser Reaktionen kann etwas kompliziert sein, aber die globale Gleichung, die nur die Reagenzien und Produkte anzeigt, lautet:
2naCl (aq) + Caco3(s) na2CO3(s) + caCl2(Ac)
Der Kako3 Es hat eine sehr stabile kristalline Struktur, so dass es ständig viel Energie verlangt, um sie in CO zu zersetzen2. Darüber hinaus erzeugt dieser Prozess große Mengen an CACl2 (Calciumchlorid) und andere Verunreinigungen, deren Entladungen die Qualität von Wasser und Umwelt beeinflussen.
Es gibt auch andere Methoden zur Natriumcarbonatproduktion in Industriebereichen wie Hou- und LeBlanc -Prozessen.
Heute ist es nachhaltig, dass es sich aus den natürlichen Mineralien bezieht, wobei die Trona die am häufigsten vorkommende von diesen ist.
Andererseits bestand die traditionellste Methode aus dem Kultivieren und Verbrennen von Pflanzen und Algen, die reich an Natrium sind. Dann wurde die Asche mit Wasser gebadet und bis zum Produkt erhitzt. Von hier aus kam Sosas berühmte Asche auf.
Natriumcarbonateigenschaften
Dann ein2CO3 Es handelt.
Seine Eigenschaften ändern sich, wenn ein Wassermolekül in seine kristalline Struktur eingebaut ist. Da Wasser Wasserstoffbrücken und den "offenen Raum" zwischen ihnen bilden kann, nimmt das Volumen des Glass zu und die Dichte des Hydrats nimmt ab. Zum Beispiel für NA2CO3· 10H2Oder seine Dichte beträgt 1,46 g/ml.
Kann Ihnen dienen: reversible Reaktion: Eigenschaften und BeispieleDann ein2CO3 schmilzt bei 851 ° C und zersetzt sich nach der folgenden Gleichung:
N / A2CO3(s) => na2Oder (s) + co2(G)
Wieder trotz der Co -Ionen32- und na+ Sie unterscheiden sich in Größen, ihre elektrostatischen Wechselwirkungen sind sehr effizient und halten ein stabiles kristallines Netzwerk bei.
Wassermoleküle "behindern" diese Wechselwirkungen und infolgedessen sind Hydrate anfälliger für Zersetzung als Anhydrid.
Es ist ein einfaches Salz; Das heißt, in Wasser gelöst erzeugt eine Lösung mit einem pH -Wert von mehr als 7. Dies liegt an der Hydrolyse von CO32-, deren Reaktion freisetzt oh- mitten drin:
CO32-(Ac) + h2Oder (l) HCO3-(Ac) + oh-(Ac)
Es ist sehr löslich in Wasser- und polaren Lösungsmitteln wie Glycerin, Glycerin, Aceton, Acetaten und flüssigem Ammoniak.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. In Gruppe 1 Elemente. (Vierte Edition., P. 265). Mc Graw Hill.
- Scifun.Org. (2018). Natriumhydrogencarbonat und Natriumcarbonat. Von Scifun geborgen.Org
- Wikipedia. (2018). Natriumcarbonat. Abgerufen von.Wikipedia.Org
- Pubchem. (2018). Natriumcarbonat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung
- Ciner Resources Corporation. (2018). Soda. Ciner erholte sich.uns.com
- Peltier k. (3. Juli 2018). Alles, was Sie über Natriumcarbonit wissen müssen. Abgerufen am 8. April 2018 von: thesprce.com
- Netzindustrie. (2018). Natriumcarbonat - Verwendungszwecke von Natriumcarbonat. Abgerufen am 8. April 2018 von: Science.Jank.Org

