Zinkcarbonat (ZNCO3) -Struktur, Eigenschaften, verwendet

- 1783
- 367
- Lewis Holzner
Er Zinkcarbonat Es handelt sich um eine anorganische Verbindung, die vom Zink (Zn), Kohlenstoff (C) und Sauerstoff (O) (O) (O) gebildet wird. Seine chemische Formel ist Znco3. Zink hat einen Oxidationszustand von +2, Carbon +4 und Sauerstoff -2.
Es ist ein farbloser oder weißer Feststoff, der in der Natur das Smithsonite -Mineral bildet, in dem es allein oder mit anderen Elementen wie Cobalt oder Kupfer sein kann, die ihm eine violette bzw. grüne Färbung verleihen.
 Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-c-by-sa-3.0/cc By-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-c-by-sa-3.0/cc By-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Der Znco3 Es ist in Wasser fast unlöslich, aber es ist leicht in verdünnten Säuren gelöst, wie das Carbonation in saurer karbononischer Form (H)2CO3), was dann zum CO -Gas wird2 und Wasser.
Es wird als Antiseptikum in tierischen Wunden verwendet und manchmal in der Ernährung geliefert, um Krankheiten zu vermeiden, die durch Zinkmangel verursacht werden.
Es dient dazu, die verbrannten zu verzögern, die bestimmte Fasern, Kunststoffe und Zahnfleisch, wenn sie mit Feuer in Kontakt kommen. Ermöglicht es, giftige Arsenmineralien sicher von anderen Felsen zu trennen.
Es wurde in dentifrischen Pasten verwendet, um Dentin in den Zähnen unter Whitening zu erholen.
[TOC]
Struktur
Der Znco3 Es wird durch ein Zn -Kation gebildet2+ und ein Anion Co32-. Carbon im Carbonation hat einen Oxidationszustand von +4. Dieses Ion hat eine flache Struktur mit den drei Sauerstoffatomen, die das Kohlenstoffatom umgeben.
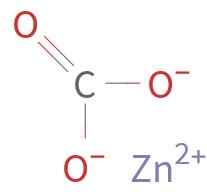 Chemische Struktur von Zinkcarbonat. Unbekannter Autor / Public Domain. Quelle: Wikimedia Commons.
Chemische Struktur von Zinkcarbonat. Unbekannter Autor / Public Domain. Quelle: Wikimedia Commons. Nomenklatur
- Zinkcarbonat
- Zinkmonokarbonat
- Kohlensäurebinksalz
- Smithsonita
- Zinkspucke
Eigenschaften
Körperlicher Status
Farbloser fester oder kristalline Weiß. Rombische Kristalle.
 Zinkcarbonat. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons.
Zinkcarbonat. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons. Molekulargewicht
125,4 g/mol
Schmelzpunkt
Bei 140 ºC bricht es ohne Schmelzen zusammen.
Dichte
4,398 g/cm3 bei 20 ° C.
Löslichkeit
Praktisch unlöslich im Wasser: 0,000091 g/100 g H2Oder bei 20 ° C. Löslich in verdünnten Säuren, Alkalien und Ammoniumsalzen. Unlöslich in Ammoniak, Alkohol und Aceton.
Chemische Eigenschaften
Reagiert mit Säuren, die Kohlendioxid bilden:
Znco3 + 2 h+ → Zn2+ + H2Oder + co2↑
Es löst sich in Basen auf, die Hydroxid bilden, das teilweise gelöst ist und ein Ion von Zinkato bildet:
Kann Ihnen dienen: Brom: Geschichte, Struktur, elektronische Konfiguration, Eigenschaften, verwendetZnco3 + 2 OH- → Zn (OH)2 + CO32-
Zn (OH)2 + H2Oder + oh- → [Zn (OH)3(H2ENTWEDER)]-
Es ist nicht brennbar. Wenn er auf seine Zersetzung erhitzt wird, produziert Zinkoxid und Kohlendioxid, kann aber Kohlenmonoxid (CO) emoxid ausgehen.
Znco3 + Wärme → ZnO + Co2↑
Erhalten
Das Smithsonite -Mineral wird erhalten, früher Zincs Spucke genannt.
Es kann auch durch Mischen einer Natriumcarbonatlösung mit einem Zinksalz wie Zinksulfat hergestellt werden. Natriumsulfat bleibt gelöst und Zinkcarbonat schlägt aus:
ZnSO4 + N / A2CO3 → Znco3↓ + na2SW4
Anwendungen
In medizinischen Behandlungen
Mit dieser Verbindung können Sie einige pharmazeutische Produkte erhalten. Es wird in Form von Staub oder Lotion auf die entzündete Haut angewendet.
In Tierärzten
Der Znco3 Es dient als adstringierender, antiseptischer und topischer Beschützer von Tieren bei Tieren.
Es ermöglicht auch, Krankheiten zu verhindern, die durch Zinkmangel verursacht werden, so.
 Zinkcarbonat wird manchmal als Mikronährstoff verabreicht, um Krankheiten bei Schweinen zu vermeiden. Unbekannter Autor / CC0. Quelle: Wikimedia Commons.
Zinkcarbonat wird manchmal als Mikronährstoff verabreicht, um Krankheiten bei Schweinen zu vermeiden. Unbekannter Autor / CC0. Quelle: Wikimedia Commons. In Porcheratosis -Ausbrüchen bei Schweinen wird es der Ernährung von diesen hinzugefügt. Diese Krankheit ist eine Veränderung der Haut, in der die Hornhautschicht nicht richtig gebildet wird.
Als Flammschutzmittel
Es wird als feuerfeste Füllung für Gummi und Kunststoffe verwendet, die hohen Temperaturen ausgesetzt sind. Ermöglicht es Ihnen, Textilfasern vor Feuer zu schützen.
Bei Baumwolltextilien wird es zusammen mit einigen Alkali auf den Stoff aufgetragen. Dies greift direkt primäre Hydroxylgruppen (-ch) an (-ch "2OH) von Cellulose und macht sie Sodiocellulose (-ch2AUF EINEN).
Das Bruch von Celluloseverbindungen durch das Alkali bevorzugt eine stärkere Durchdringlichkeit der Ketten der kompakten Zellulosestruktur, so dass mehr Znco -Menge3 Schwert.
Kann Ihnen dienen: Vanadium: Geschichte, Eigenschaften, Struktur, verwendet Einige Baumwollstoffe können Znco enthalten3 in ihren Fasern, um sie gegen Feuer resistent zu machen. SOCKEN_FARBIG.JPEG: Scott Bauererivatives Werk: Sock / Public Domain. Quelle: Wikimedia Commons.
Einige Baumwollstoffe können Znco enthalten3 in ihren Fasern, um sie gegen Feuer resistent zu machen. SOCKEN_FARBIG.JPEG: Scott Bauererivatives Werk: Sock / Public Domain. Quelle: Wikimedia Commons. Infolgedessen wird die Menge an brennbarem Gas, die mit Brand auftreten könnte, verringert.
In Zahnbehandlungen
Bestimmte dentifische Cremes, die auf Zinkcarbonat -Nanokristallen und Hydroxyapatit basieren, die regelmäßig auf Zahnersatz angewendet werden.
Die Nanokristalle von Znco3 und Hydroxiapatit haben eine Größe, Form, chemische Zusammensetzung und Kristallinität, die dem des Dentins ähnelt, so dass die Dentinal -Tubuli mit diesen Materialien geschlossen werden können.
 ZnCO -Nanopartikel3-HydroxiaPathit wurde erfolgreich getestet, um die Empfindlichkeit in gebleichten Zähnen zu verringern. Autor: Fotomischung. Quelle: Pixabay.
ZnCO -Nanopartikel3-HydroxiaPathit wurde erfolgreich getestet, um die Empfindlichkeit in gebleichten Zähnen zu verringern. Autor: Fotomischung. Quelle: Pixabay. Diese Art von Zahnpasten war nach Zahnaufhellungsprozessen nützlich.
Gefährliche Arsenmineralien zu trennen
Arsen -Mineralmethoden von Schwefelgesteinen (wie Galena, Chalcopyrit und Pyrit) wurden unter Verwendung von ZNCO getestet)3. Das Erz in Arsen muss von anderen getrennt werden, da dieses Element ein sehr giftiger und giftiger Schadstoff für Lebewesen ist.
Um dies zu erreichen, wird die Mischung aus gemahlenen Gesteinen mit einer Zinksulfatlösung und Natriumcarbonat zu einem pH-Wert von 7,5-9,0 und einer Xantat-Verbindung behandelt.
 Arsenopirita. Dieses Mineral sollte von anderen getrennt werden, da es Arsengift enthält. Trennung kann mit Zinkcarbonat erreicht werden. James St. John/CC von (https: // creevecommons.Org/lizenzen/by/2.0). Quelle: Wikimedia Commons.
Arsenopirita. Dieses Mineral sollte von anderen getrennt werden, da es Arsengift enthält. Trennung kann mit Zinkcarbonat erreicht werden. James St. John/CC von (https: // creevecommons.Org/lizenzen/by/2.0). Quelle: Wikimedia Commons. Die Wirksamkeit der Formel wird auf die Bildung kleiner Znco -Partikel zurückgeführt3 Auf der Oberfläche des Arsenopyrits, was es hydrophil (im Zusammenhang mit Wasser) macht, können Sie nicht an Luftblasen haften und können nicht schwimmen, sich von den anderen Mineralien ausfassen und sich voneinander trennen.
Bei der Erlangung anderer Zinkverbindungen
Zinkcarbonat wurde verwendet, um hydrophobe Nanostrukturen von Borat der Formel 3ZNO zu erhalten. • 3b2ENTWEDER3• 3.5H2ENTWEDER. Dieses Material kann als flammhemmender Additiv in Polymeren, Holz und Textilien verwendet werden.
Bei der Wiederherstellung von Zink von Restabwässern
Reiche synthetische Gewässer auf Zinkionen, die durch Elektropositionsprozesse verworfen werden, können durch flüssige Betttechnologie unter Verwendung von Natriumcarbonat behandelt werden, um Znco auszurüsten3.
Kann Ihnen dienen: sekundärer Alkohol: Was ist, Struktur, Eigenschaften, verwendetWenn der Zn ausfällt2+ In Form von Carbonat verringert sich die Konzentration, der erhaltene Feststoff wird gefiltert und das Wasser kann sicher weggeworfen werden. Der Znco3 Niederschlag ist eine hohe Reinheit.
Andere Apps
Ermöglicht die Vorbereitung anderer Zinkverbindungen. Es wird in Kosmetika verwendet. Es dient als Pigment und wird bei der Herstellung von Porzellan, Keramik und Keramik verwendet.
Risiken
Znco -Staubeinatmung3 Es kann zu Herrschaften, Husten, Brust, Fieber und Schwitzen führen. Seine Einnahme erzeugt Übelkeit und Erbrechen.
Auswirkungen auf die Umwelt
Das Hauptrisiko ist die Auswirkung auf die Umwelt, daher sollte es vermieden werden, darin verstreut zu sein. Es ist sehr giftig für das Wasserleben mit Konsequenzen, die in lebenden Organismen dauern.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Zinkcarbonat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Sharma, v. et al. (2018). Synthese von Zinkcarbonat -Nanoneedles, um potenzielle Flammschutzmittel für Baumwolltextilien. Cellulose 25, 6191-6205 (2018). Link wiederhergestellt.Springer.com.
- Guan und. et al. (2020). Kolloidaler ZnCO3 als starkes Depressivum von Arsenopyrit in schwach alkalischer Zellstoff und dem Wechselwirkungsmechanismus. Mineralien 2020, 10, 315. MDPI erholt sich.com.
- Hautkrankheiten, Auge, Bindehaut und Außenohr. (2017). In Veterinärmedizin (elfte Ausgabe). Von Scientedirect erholt.com.
- Hannig, m. und Hannig, c. (2013). Nanobiomaterialien in der vorbeugenden Zahnmedizin. In Nanobiomaterialien in der klinischen Zahnheilkunde. Kapitel 8. Von Scientedirect erholt.com.
- Tugrul, n. et al. (2015). Synthese von hydrophoben Nanostrukturen Zinkborrate aus Zinkcarbonat und Charakterisierung des Produkts. Res Chem-Intermediate (2015) 41: 4395-4403. Link wiederhergestellt.Springer.com.
- Luna, m.D.G., et al. (2020). Wiederherstellung von Zinkkörnern aus synthetischer elektroplierendem Abwasser unter Verwendung flüssiger homogener Kristallisationsprozess. Int. J. Umfeld. Sci. Technol. 17, 129-142 (2020). Link wiederhergestellt.Springer.com.
- « Besondere und universelle Sätze Eigenschaften
- Was ist der wirtschaftliche Prozess? Stufen und Beispiele »

