Kohlenstoff

- 2531
- 281
- Rieke Scheer
Was ist Kohlenstoff?
Er Kohlenstoff Es ist ein nicht -metallisches chemisches Element, dessen chemisches Symbol C ist. Sein Name ist auf Kohle, Gemüse oder Mineral zurückzuführen, wo seine Atome verschiedene Strukturen definieren. Es bildet eine breite Palette von organischen und anorganischen Verbindungen und präsentiert sich auch in einer beträchtlichen Anzahl von Alotropen.
Kohlenstoff ist in allen Lebewesen zu finden; Alle seine Biomoleküle verdanken seine Existenz der Stabilität und Stärke der C-C-Bindungen und ihrer hohen Tendenz zur Verkettung. Es ist das Element des Lebens und mit ihren Atomen werden ihr Körper gebaut.
Die organischen Verbindungen, mit denen Biomaterialien gebaut sind. Diese sind auf den ersten Blick im Holz der Bäume zu sehen; Und auch, wenn Blitz auf sie fällt und Rostiza. Der verbleibende inerte schwarze Feststoff hat auch Kohlenstoff; Aber es ist eine Gemüsekohle.
Kohlenstoffeigenschaften
Die physikalischen oder chemischen Eigenschaften, die in Feststoffen, Mineralien oder kohlenstoffhaltigen Materialien enthalten sind, unterliegen vielen Variablen. Unter ihnen sind: die Zusammensetzung oder der Grad der Verunreinigungen, die Hybridationen von Kohlenstoffatomen, die Vielfalt der Strukturen und die Morphologie oder Größe der Poren.
Wenn die Eigenschaften von Kohlenstoff beschreiben, basiert die Mehrheit der bibliografischen Texte oder Quellen auf Graphit und Diamond.
Weil? Weil sie die bekanntesten Alotrope für dieses Element sind und Feststoffe oder hohe Reinheitsmaterialien darstellen; Das heißt, sie werden praktisch nichts weiter als Kohlenstoffatome gemacht (obwohl im folgenden Abschnitt mit unterschiedlichen Strukturen erklärt werden).
Die Eigenschaften von Gemüse- und Mineralkohle unterscheiden sich in ihren Ursprüngen oder Zusammensetzungen. Zum Beispiel Braunkohle (schlechter Kohlenstoff) als Gatea -Kraftstoff im Vergleich zu Anthrazit (Kohlenstoffreich). Und was über die anderen Alotropes zu sagen ist: Nanoröhren, Fullerenos, Graphen, Graphos usw.
Sie haben jedoch chemisch einen gemeinsamen Punkt: Sie oxidieren mit einem Überschuss an Sauerstoff in CO2:
C + ENTWEDER2 => Co2
Jetzt sind die Geschwindigkeit oder Temperatur, die sie zum Oxidieren benötigen.
Graphit gegen Diamond
Hier wird auch ein kurzer Kommentar zu den verschiedenen Eigenschaften für diese beiden Alotrope abgegeben:
 Tabelle, in der einige Eigenschaften der beiden kristallinen Alotrops von Kohlenstoff verglichen werden. Quelle: Gabriel Bolívar.
Tabelle, in der einige Eigenschaften der beiden kristallinen Alotrops von Kohlenstoff verglichen werden. Quelle: Gabriel Bolívar. Elektronische Struktur und Konfiguration
Hybridationen
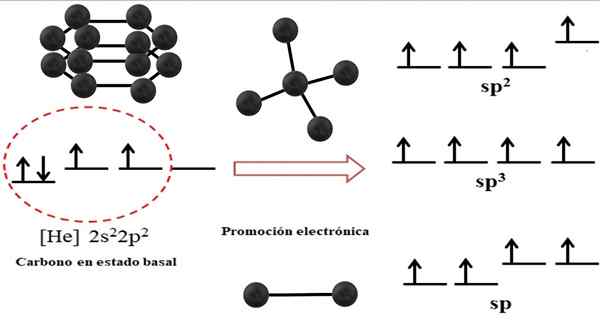 Beziehung zwischen hybriden Orbitalen und möglichen Strukturen für Kohlenstoff. Quelle: Gabriel Bolívar.
Beziehung zwischen hybriden Orbitalen und möglichen Strukturen für Kohlenstoff. Quelle: Gabriel Bolívar. Die elektronische Konfiguration für das Kohlenstoffatom beträgt 1s22s22 p2, auch als [er] 2s geschrieben22 p2 (oberes Bild). Diese Darstellung entspricht ihrem Grundstatus: das in einem solchen Vakuum isolierte und suspendierte Kohlenstoffatom, das nicht mit anderen interagieren kann.
Kann Ihnen dienen: Kristalline StrukturEs wird geschätzt, dass einer seiner 2p -Orbitale Elektronen fehlt, was ein Elektron des weniger Energieorbitals durch elektronische Beförderung akzeptiert. Und so erwirbt das Atom die Fähigkeit, bis zu vier kovalente Bindungen durch seine vier SP -Hybridorbitale zu bilden3.
Beachten Sie, dass die vier Orbitale sp3 Sie sind energie degeneriert (auf dem gleichen Niveau ausgerichtet). Die Orbitale P Rein sind energischer, weshalb sie über den anderen Hybridorbitalen liegen (rechts vom Bild).
Wenn es drei hybride Orbitale gibt, liegt es daran, dass ein Orbital bleibt P ohne Hybridisierung; Daher sind es drei SP -Orbitale2. Und wenn es zwei dieser hybriden Orbitale gibt, zwei Orbitale P Sie stehen zur Verfügung, um doppelte oder dreifache Bindungen zu bilden, was die Hybridisierung des F -Kohlenstoffs ist.
Solche elektronischen Aspekte sind wichtig zu verstehen, warum Kohlenstoff in Alotropen -Unendlichkeiten gefunden werden kann.
Oxidationszahlen
Bevor Sie mit den Strukturen fortfahren, müssen Sie angesichts der elektronischen Konfiguration von Valencia 2 nicht erwähnen22 p2, Kohlenstoff kann die folgenden Oxidationszahlen haben: +4, +2, 0, -2 und -4.
Weil? Diese Zahlen entsprechen der Annahme, dass es eine ionische Bindung gibt, sodass Sie die Ionen mit den jeweiligen Lasten bilden. das heißt, c4+, C2+, C0 (neutral), c2- und C4-.
Damit Kohlenstoff eine positive Oxidationszahl aufweist, muss er Elektronen verlieren; Und dazu muss es notwendigerweise mit sehr elektronegativen Atomen (wie Sauerstoff) in Verbindung gebracht werden.
Damit Kohlenstoff eine negative Oxidationszahl aufweist, muss es Elektronen gewinnen, die mit Metall oder weniger elektronegativen Atomen verbunden sind als er (wie Wasserstoff).
Das erste Oxidationsproblem, +4, bedeutet, dass Kohlenstoff alle Valenzelektronen verloren hat; Die Orbitale 2s und 2p sind leer. Wenn das 2P -Orbital seine beiden Elektronen verliert, hat der Kohlenstoff +2 Oxidationszahl; Wenn Sie zwei Elektronen gewinnen, haben Sie -2; Und wenn er zwei Elektronen gewinnt, die sein Oktett aus Valencia vervollständigen, -4.
Beispiele
Zum Beispiel für co2 Die Kohlenstoffoxidationszahl beträgt +4 (weil Sauerstoff elektronegativer ist); während für Cho4, ist -4 (weil Wasserstoff weniger elektronegativ ist).
Kann Ihnen dienen: Hydrazin: Struktur, Eigenschaften, Synthese, verwendetFür ch3Oh, die Kohlenstoffoxidationszahl beträgt -2 (+1 für H und -2 für O); Während für HCOOH ist es +2 (prüfen Sie, dass die Summe von 0).
Andere Oxidationszustände wie -3 und +3 sind ebenfalls wahrscheinlich, insbesondere wenn es um organische Moleküle geht. Zum Beispiel in Methylgruppen -ch3.
Molekulare Geometrien
Im überlegenen Bild wurden nicht nur die Hybridisierung der Orbitale für das Kohlenstoffatom gezeigt, sondern auch die resultierenden molekularen Geometrien, wenn mehrere Atome (schwarze Kugeln) mit einem Zentral verbunden sind. Dieses zentrale Atom muss eine bestimmte geometrische Umgebung im Weltraum entsorgen, um die jeweilige chemische Hybridisierung zu besitzen, die erlaubt ist.
Zum Beispiel hat der zentrale Kohlenstoff für das Tetraeder SP -Hybridisierung3; Weil dies die stabilste Anordnung für die vier Hybrid -SP ist3. Im Falle von SP -Kohlenstoffen2, Sie können doppelte Verbindungen bilden und eine trigonale flache Umgebung entsorgen. Und so definieren diese Dreiecke ein perfektes Sechseck. Und für eine SP -Hybridisierung nehmen Kohlenstoffe eine lineare Geometrie ein.
So werden die in den Strukturen aller Alotrope beobachteten Geometrien einfach in Tetraedra (SP) regiert3), Sechsecke oder Pentagone (SP2) und Linien (sp).
Tetraedra definiert eine 3D -Struktur, während Sechsecke, Pentagone und Linien, 3D- oder 2D -Strukturen; Letztere sind die Ebenen oder Blätter ähnlich wie die Wände der Bienenhaben:
 Wand mit hexagonalen Designs einer Bienenwabe in Analogie zu den Ebenen, die aus SP2 -Kohlenstücken bestehen, bestehen. Quelle: Pixabay.
Wand mit hexagonalen Designs einer Bienenwabe in Analogie zu den Ebenen, die aus SP2 -Kohlenstücken bestehen, bestehen. Quelle: Pixabay. Und wenn wir diese hexagonale Wand (fünfeckig oder gemischt) falten, erhalten wir eine Röhre (Nanoröhren) oder eine Kugel (Fulleren) oder eine andere Figur. Die Wechselwirkungen zwischen diesen Zahlen führen zu unterschiedlichen Morphologien.
Amorphe oder kristalline Feststoffstoffe
Verlassen Sie Geometrien, Hybridisierungen oder Morphologien der möglichen Kohlenstoffstrukturen, ihre Feststoffe können weltweit in zwei Arten einteilen: amorph oder kristalline. Und zwischen diesen beiden Klassifikationen sind ihre Alotrope verteilt.
Amorphes Kohlenstoff ist einfach derjenige, der eine willkürliche Mischung aus Tetraeder, Sechsstern oder Linien darstellt, die kein strukturelles Muster herstellen können. Dies ist der Fall von Kohle, Gemüse oder Aktivkohle, Cola, Ruß usw.
Während kristalliner Kohlenstoff aus strukturellen Mustern besteht, die durch eine der angesprochenen Geometrien gebildet werden; Zum Beispiel Diamond (dreidimensionales Tetraeder -Netzwerk) und Graphit (gestapelte sechseckige Blätter).
Kann Ihnen dienen: Natriumnitrat (Nano3): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenWo ist Kohlenstoff?
Kohlenstoff in der Natur ist nicht nur das chemische Element, das in allen Lebensformen gemeinsam ist, sondern auch in drei kristallinen Formen vorhanden: Diamant, Graphit und Führer.
Es gibt auch mehrere amorphe Kohlemineralformen (Anthrazit, Braunkohle, Dumm, Torf), flüssige Formen (Erdölsorten) und Soda (Erdgas).
Anwendungen
Auch wie die Eigenschaften und Struktur stimmen die Verwendungen oder Anwendungen mit den Alotrogos oder mineralogischen Formen von Kohlenstoff überein. Zusätzlich zu einigen sehr bekannten Punkten gibt es jedoch bestimmte Allgemeinheiten, die erwähnt werden können. So sind:
-Kohlenstoff wurde seit langem als Mineralreduzierungsmittel für die Erlangung reiner Metalle eingesetzt. Zum Beispiel Eisen, Silizium und Phosphor unter anderem.
-Es ist der Eckpfeiler des Lebens, und die organische Chemie und Biochemie sind das Studium dieser Reflexion.
-Es war auch ein fossiler Brennstoff, der es den ersten Maschinen ermöglichte, zu ihren Zahnrädern zu gehen. Auf die gleiche Weise wurde Carbongas für alte Beleuchtungssysteme von ihm erhalten. Kohle war ein Synonym für Licht, Wärme und Energie.
-Gemischt als Additiv mit Eisen in unterschiedlichen Proportionen ermöglichte die Erfindung und Verbesserung von Stählen.
-Seine schwarze Farbe fand in Kunst statt, insbesondere Graphit und alle Schriften mit ihren Schlägen.
Risiken und Vorsichtsmaßnahmen
Kohlenstoff und seine Feststoffe stellen kein Gesundheitsrisiko dar. Wer hat sich Sorgen um eine Kohlenbeutel gemacht? Sie verkaufen sie an Lose in den Hallen einiger Märkte, und solange es kein Brand gibt, werden ihre schwarzen Blöcke nicht verbrennen.
Die Cola kann dagegen ein Risiko darstellen, wenn ihr Schwefelgehalt hoch ist. Wenn die Verbrennung Schwefelgase freigesetzt wird, die nicht nur toxisch sind. Und obwohl der co2 In kleinen Mengen kann es uns nicht ersticken, es hat einen enormen Einfluss auf die Umwelt als Treibhausgas.
Aus dieser Perspektive ist Carbon eine "langfristige" Gefahr, da seine Verbrennung das Klima unseres Planeten verändert.
Und körperlicher werden Feststoffe oder kohlenstoffhaltige Materialien, wenn sie besprüht werden, leicht durch Luftströmungen transportiert werden; Und folglich werden sie direkt in die Lunge eingeführt, was sie unwiderruflich schädigen kann.
Von den anderen ist es sehr häufig, „Kohle“ zu konsumieren, wenn etwas Essen kocht.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- « Eigenschaften Lagomorphe, Lebensmittel, Reproduktion, Lebensraum
- Was ist was bei Mitose bei Meiose ist »

