Anomerischer Kohlenstoff Was ist, Eigenschaften, Beispiele
- 3466
- 210
- Joy Hort
Er Anomerer Kohlenstoff Es ist ein Stereokentro, das in den zyklischen Strukturen von Kohlenhydraten (Mono oder Polysaccharide) vorhanden ist). Als Stereozentro leitet sich zwei Diastereoisomere aus, die mit α- und β -Buchstaben bezeichnet werden; Dies sind die Anomere und sind Teil der umfangreichen Nomenklatur in der Welt des Zuckers.
Jedes Anomer, α oder β, unterscheiden sich in der Position der OH -Gruppe des Anómerico -Kohlenstoffs in Bezug auf den Ring; Aber in beiden Fällen ist der anomere Kohlenstoff gleich und befindet sich am selben Ort des Moleküls. Anomere sind cyclische Hemiacetale, Produkte einer intramolekularen Reaktion in der offenen Kette von Zucker; Sei Aldose (Aldehydos) oder Ketosas (Ketone).
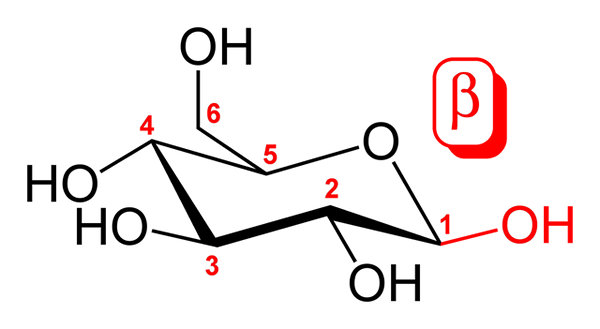
 Stuhlkonformation für β-D-Glucopyranose. Quelle: Commons Wikimedia.
Stuhlkonformation für β-D-Glucopyranose. Quelle: Commons Wikimedia. Das obere Bild zeigt die Konformation des Stuhls für β-D-Glucopyranose. Wie zu sehen ist, besteht es aus einem sechs Mitgliedsring, einschließlich eines Sauerstoffatoms zwischen den Kohlenstoffen 5 und 1; Letzteres oder eher der erste ist der Anómerico -Kohlenstoff, der zwei einfache Bindungen mit zwei Sauerstoffatomen bildet.
Wenn es im Detail beobachtet wird, ist die OH Carbon 1 Gruppe 1 über dem sechseckigen Ring sowie der CH -Gruppe ausgerichtet2Oh (Carbon 6). Dies ist das β -Anomer. Das α -Anomer hingegen würde sich nur in dieser OH -Gruppe unterscheiden, die den Ring entlang befinden würde, als wäre es ein Trommelisomer.
Hemiecetale
Es ist notwendig, sich im Konzept von Hemiacetals ein wenig mehr zu vertiefen, um anomere Kohlenstoff besser zu verstehen und zu unterscheiden. Hemiacetale sind das Produkt einer chemischen Reaktion zwischen einem Alkohol und einem Aldehyd (Aldose) oder einem Keton (Ketosas).
Diese Reaktion kann mit der folgenden allgemeinen chemischen Gleichung dargestellt werden:
Kann Ihnen dienen: Polyvinylpirrolidon: Struktur, Eigenschaften, Verwendungen, NebenwirkungenRoh + r'cho => Roch (OH) R '
Wie zu sehen ist, reagiert ein Alkohol mit einem Aldehyd, um den Hemiacetal zu bilden. Was würde passieren, wenn sowohl R als auch R 'zur gleichen Kette gehören würden? In diesem Fall würde es einen zyklischen Hemiacetal geben, und die einzig mögliche Möglichkeit, wie er gebildet werden kann.
Darüber hinaus muss die Struktur aus einer flexiblen Kette und mit fähigen Gliedern bestehen, um den nucleophilen Angriff von OH auf den Carbonylkohlenstoff der CHO -Gruppe zu erleichtern. In diesem Fall schließt die Struktur in fünf oder sechs Mitgliedern Ring.
Zyklischer Hemiacetal
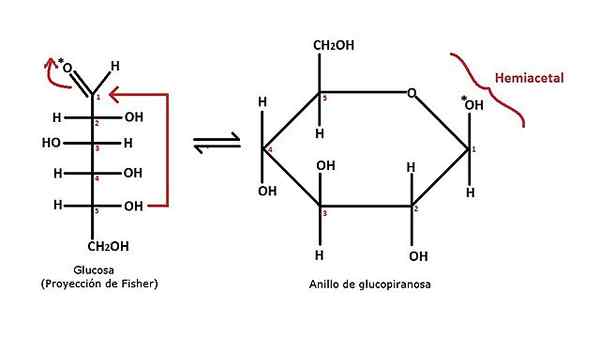 Cyclic Hemiacetal Formation. Quelle: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Cyclic Hemiacetal Formation. Quelle: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Im oberen Bild wird ein Beispiel für die Bildung eines zyklischen Hämiaketals für Glucosemonosaccharid gezeigt. Es ist zu sehen, dass es aus einer Aldosa mit einer Aldehyd -CHO -Gruppe besteht (Carbon 1). Dies wird von der OH -Gruppe von Carbon 5 angegriffen, wie durch den roten Pfeil angegeben.
Die Struktur geht von einer offenen Kette (Glukose) zu einem piranischen Ring (glucopophareous). Anfangs kann es keine Beziehung zwischen dieser Reaktion und dem neu erklärten für den Hemiacetal geben; Aber wenn der Ring sorgfältig beobachtet wird, insbesondere in Abschnitt C5-O-C1(OH) -C2, Es wird geschätzt, dass dies dem erwarteten Skelett für einen Hemiacetal entspricht.
Kohlenstoffe 5 und 2 repräsentieren R und R 'der allgemeinen Gleichung. Da diese Teil derselben Struktur sind, ist es dann ein zyklischer Hämiacetal (und der Ring reicht aus, um offensichtlich zu sein).
Eigenschaften von anomerem Kohlenstoff und wie man es erkennt
Wo ist der anomere Kohlenstoff?? In Glucose ist dies die CHO -Gruppe, die den nucleophilen Angriff von OH entweder unten oder darüber leiden kann. Abhängig von der Ausrichtung des Angriffs werden zwei verschiedene Anomere gebildet: α und β, wie bereits erwähnt.
Es kann Ihnen dienen: Chemische Phänomene: Eigenschaften und BeispieleEin erstes Merkmal, das dieser Kohlenstoff besitzt, ist, dass es in der offenen Zuckerkette derjenige ist, der den nukleophilen Angriff litt. Das heißt, es ist die Cho -Gruppe für die Aldos oder die R -Gruppe2C = o für Ketusse. Sobald jedoch der zyklische Hemiacetal oder der Ring gebildet ist, kann dieser Kohlenstoff den Eindruck erwecken, verschwunden zu sein.
Hier gibt es noch andere spezifischere Merkmale, um sie in jedem Piranoso- oder Furanring jedes Kohlenhydrats zu lokalisieren:
-Der anomere Kohlenstoff befindet sich immer rechts oder links vom Sauerstoffatom, das den Ring bildet.
-Noch wichtiger ist, dass dies nicht nur mit diesem Sauerstoffatom, sondern auch mit der OH -Gruppe von Cho oder R verbunden ist2C = O.
-Es ist asymmetrisch, das heißt, es hat vier verschiedene Substituenten.
Mit diesen vier Eigenschaften ist es leicht, die anomere Kohlenstoff zu erkennen, die jede "süße Struktur" beobachtet,.
Beispiele
Beispiel 1
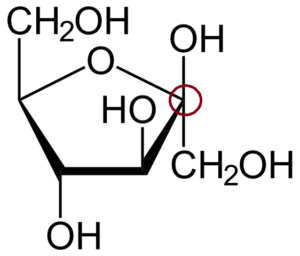 β-D-Fructofuranosa. Quelle: Neurotoger (Diskussion • Beiträge) [Public Domain]
β-D-Fructofuranosa. Quelle: Neurotoger (Diskussion • Beiträge) [Public Domain] Hoch.
Um den anomeren Kohlenstoff zu identifizieren, müssen Sie zuerst die Kohlenstoffe auf der linken und rechten Seite des Sauerstoffatoms beobachten, das den Ring bildet. Dann ist derjenige, der mit der OH -Gruppe verbunden ist, der anomere Kohlenstoff; dass es in diesem Fall bereits in einem roten Kreis eingesperrt ist.
Dies ist das β -Anomer, weil das OH des anomeren Kohlenstoffs über dem Ring liegt, genau wie der Chip2Oh.
Beispiel 2
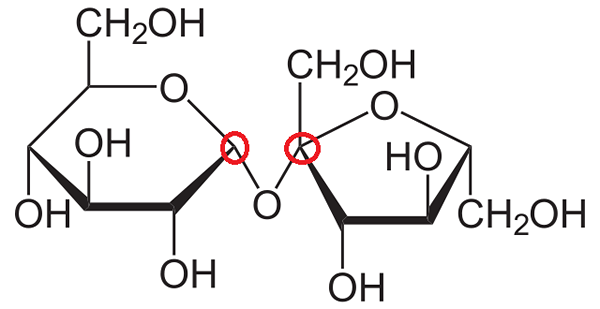 Saccharose. Quelle: Neurotoger über Wikipedia.
Saccharose. Quelle: Neurotoger über Wikipedia. Jetzt wird versucht zu erklären, welche anomeren Kohlenstoffe in der Struktur von Saccharose sind. Wie zu sehen ist, besteht es aus zwei monosacchariden, die kovalent durch eine glycosidische Bindung verbunden sind, -o-.
Kann Ihnen dienen: Natriumpermanganat (Namno4): Eigenschaften, RisikenDer rechte Ring ist genau der gleiche neu kommentierte: β-d-fructofuranosa, nur dass er nach links „gedreht“ wird. Der anomere Kohlenstoff bleibt für den vorherigen Fall gleich und erfüllt alle Eigenschaften, die davon zu erwarten sind.
Andererseits ist der Ring links die α-D-Glucopyranose.
Wiederholung des gleichen Verfahrens zur Erkennung des anomeren Kohlenstoffs und der Betrachtung der beiden Kohlenstoffe links und rechts vom Sauerstoffatom wird festgestellt, dass der rechte Kohlenstoff mit der OH -Gruppe verbunden ist. die an der glucosidischen Bindung beteiligt ist.
Daher sind beide anomeren Kohlenstoffe mit dem -o- verbunden, und deshalb sind sie in roten Kreisen eingesperrt.
Beispiel 3
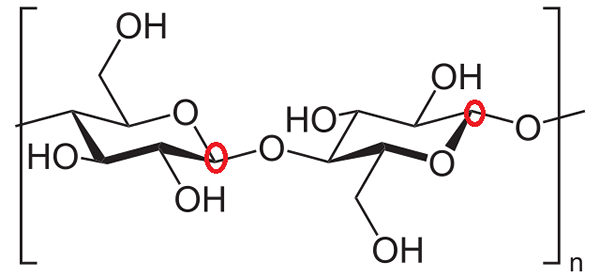 Zellulose. Quelle: Neurotoger [Public Domain]
Zellulose. Quelle: Neurotoger [Public Domain] Schließlich wird vorgeschlagen, die anomeren Kohlenstoffe zweier Glukoseeinheiten in Cellulose zu identifizieren. Wieder werden Kohlenstoffe um Sauerstoff im Ring beobachtet, und es wird festgestellt, dass im Glukosering links der anomere Kohlenstoff an der glucosidischen Bindung teilnimmt (im roten Kreis gesperrt).
Im Glukosering rechts ist der anomische Kohlenstoff rechts rechts von Sauerstoff und ist leicht zu identifizieren, da er mit dem Sauerstoff der glucosidischen Bindung verbunden ist. Somit sind beide anomeren Kohlenstoffe vollständig identifiziert.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5ta Auflage. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley Plus.
- Rendina g. (1974). Angewandte Biochemie -Techniken. Inter -American, Mexiko.
- Chang s. (S.F.). Eine Anleitung zum anomeren Kohlenstoff: Was ist ein anomerer Kohlenstoff?? [PDF]. Erholt von: Chem.UCLA.Edu
- Gunawardena G. (13. März 2018). Kohleanomer. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Fertigung l. (2019). Anomerischer Kohlenstoff: Definition & Übersicht. Lernen. Erholt von: Studium.com

