Calciumcarbid (CAC2) -Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 895
- 12
- Joe Hartwig
Er Calciumcarbid Es handelt sich um eine anorganische Verbindung, die durch Calcium (CA) und Kohlenstoff (C) Elemente (c) gebildet wird. Seine chemische Formel ist CAC2. Es ist ein Feststoff, der farblos bis gelblich oder grauweiß und sogar schwarz sein kann, je nach den Verunreinigungen, die es enthält.
Eine seiner wichtigsten chemischen Reaktionen des CAC2 ist derjenige, der mit Wasser h auftritt2Oder, in welcher HC≡CH -Acetylen bilden. Daher wird es verwendet, um Acetylen industriell zu erhalten. Aufgrund derselben Wasserreaktion wird die Früchte, in falschen Kanonen und in Marine -Fackeln verwendet, um Früchte zu reifen.
 CAC Calciumcarbid2 solide. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons.
CAC Calciumcarbid2 solide. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons. Die Reaktion des CAC2 Mit Wasser erzeugt auch einen nützlichen Schlamm, um Klinker (eine Zementkomponente) vorzubereiten, die weniger Kohlendioxid erzeugt (CO)2) Im Vergleich zur traditionellen Methode zur Herstellung von Zement.
Mit Stickstoff (n2) Calciumcarbid bilden Cyanamid aus Kalzium, das als Dünger verwendet wird. Der CAC2 Es wird auch verwendet, um Schwefel aus bestimmten Metalllegierungen zu entfernen.
Vor einiger Zeit der CAC2 Es wurde in den sogenannten Carbid -Lampen verwendet, aber diese sind nicht mehr sehr häufig, weil sie gefährlich sind.
[TOC]
Struktur
Calciumcarbid ist eine ionische Verbindung und wird durch das CA -Calcio -Ion gebildet2+ und das Carbid oder Acetyluro c22-. Das Carbid -Ion besteht aus zwei Kohlenstoffatomen, die durch eine dreifache Bindung vereint sind.
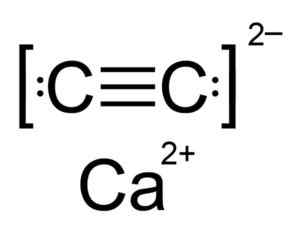 Chemische Struktur von Calciumcarbid. Autor: Hellbus. Quelle: Wikimedia Commons.
Chemische Struktur von Calciumcarbid. Autor: Hellbus. Quelle: Wikimedia Commons. Die kristalline Struktur des CAC2 Es wird vom Kubikum (wie Natriumchlorid -NaCl) abgeleitet, aber wie Ion C22- Die Struktur wird verlängert und wird tetragonal verdreht.
Nomenklatur
- Calciumcarbid
- Calciumcarbid
- Calciumacetylure
Eigenschaften
Körperlicher Status
Kristalline Feststoff, der, wenn es rein ist, farblos ist, aber wenn es mit anderen Verbindungen kontaminiert ist.
 CAC Calciumcarbid2 Mit Verunreinigungen. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
CAC Calciumcarbid2 Mit Verunreinigungen. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Molekulargewicht
64.0992 g/mol
Es kann Ihnen dienen: Alilo: Allyic Unit, Carbocation, Radical, BeispieleSchmelzpunkt
2160 ºC
Siedepunkt
Der CAC2 kocht bei 2300 ° C mit Zersetzung. Der Siedepunkt sollte unter inerter Atmosphäre gemessen werden, dh ohne Sauerstoff oder Feuchtigkeit.
Dichte
2,22 g/cm3
Chemische Eigenschaften
Calciumcarbid reagiert mit Wasser, um HC≡CH -Acetylen- und CA -Calciumhydroxid (OH) zu bilden2:
CAC2 + 2 h2O → hcighch + ca (OH)2
Acetylen ist brennbar, daher in Gegenwart von Feuchtigkeit den CAC2 Es kann brennbar sein. Wenn es jedoch trocken ist, ist es nicht.
 CAC Calciumcarbid2 Mit Wasser HC≡CH Acetylenform, brennbare Verbindung. Kristina Kravets/CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
CAC Calciumcarbid2 Mit Wasser HC≡CH Acetylenform, brennbare Verbindung. Kristina Kravets/CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Calciumcarbid reagiert mit Stickstoff N2 Cacn Calcio Cyanamid bilden2:
CAC2 + N2 → Cacn2 + C
Erhalten
Calciumcarbid wird industriell in einem elektrischen Bogenofen hergestellt, das auf einer Mischung aus Calciumcarbonat (Caco) basiert3) und Kohle (c), die bei einer Temperatur von 2000 ° C eingereicht wird. Die Reaktion wird wie folgt zusammengefasst:
Dieb3 + 3 C → CAC2 + Co ↑ + co2↑
Oder auch:
CaO + 3 C → CAC2 + Co ↑
In einem elektrischen Bogenofen gibt es einen Strombogen zwischen zwei Graphitelektroden, die den gebildeten hohen Temperaturen widerstehen. Ein Kalziumkarbid mit einer Reinheit von 80-85% wird erhalten.
Anwendungen
In der Acetylenproduktion
Industriell wird Calciumcarbidreaktion mit Wasser zur Herstellung von Acetylen C verwendet2H2.
CAC2 + 2 h2O → hcighch + ca (OH)2
Dies ist die wichtigste Verwendung von Calciumcarbid. In einigen Ländern wird Acetylen sehr geschätzt, da es ermöglicht, Polyvinylchlorid zu produzieren, was eine Art Kunststoff ist. Darüber hinaus dient Acetylen dazu, Schweißnähte bei hohen Temperaturen durchzuführen.
 HCighCh -Acetylen -Flammenmetalle bei sehr hohen Temperaturen. Autor: Shutterbug75. Quelle: Pixabay.
HCighCh -Acetylen -Flammenmetalle bei sehr hohen Temperaturen. Autor: Shutterbug75. Quelle: Pixabay. Bei der Reduzierung der CO -Emissionen2
Die Überreste,2 (Auch als „Calciumcarbidschlamm“ oder „Calciumcarbidreste“ bezeichnet) sie dienen dazu, Klinker oder Beton zu erhalten.
Kann Ihnen dienen: technologische Anwendungen der elektronischen Emission von AtomenCalciumcarbidschlamm hat einen hohen Calciumhydroxidgehalt (CA (OH)2) (ca. 90%), etwas Calciumcarbonat (Caco3) und hat einen pH -Wert von mehr als 12.
 Calciumcarbidreste können in der Konstruktionsaktivität zur Herstellung von Beton verwendet werden, wodurch die Erzeugung von CO verringert wird2 der dieser Industrie. Autor: Engin Akyurt. Quelle: Pixabay.
Calciumcarbidreste können in der Konstruktionsaktivität zur Herstellung von Beton verwendet werden, wodurch die Erzeugung von CO verringert wird2 der dieser Industrie. Autor: Engin Akyurt. Quelle: Pixabay. Aus diesen Gründen können Sie mit SiO reagieren2 Oral2ENTWEDER3 Bildung eines Produkts, das dem durch den Zementhydratationsprozess erhalten wird.
Eine der menschlichen Aktivitäten, die die meisten CO -Emissionen erzeugen2 Es ist die Bauindustrie. Die co2 Es wird während der Reaktion zur Bildung von Beton östlich von Calciumcarbonat erzeugt.
Verwenden von Calciumcarbidschlamm, um Calciumcarbonat (Caco) zu ersetzen3) Es wurde festgestellt, dass die CO -Emissionen reduziert werden2 In 39%.
Bei der Erlangung von Kalziumcyanamid
Calciumcarbid wird auch industriell verwendet, um Calciumcyanamid CACN zu erhalten2.
CAC2 + N2 → Cacn2 + C
Calciumcyanamid hat als Dünger verwendet, da es mit Bodenwasser Cyanamid H2N = C = N wird, was Pflanzen Stickstoff liefert, ein wesentlicher Nährstoff dafür.
In der metallurgischen Industrie
Kalziumkarbid wird verwendet, um Legierungen wie Ferroníquel zu entfernen. Der CAC ist gemischt2 Mit der geschmolzenen Legierung bei 1550 ° C. Schwefel (S) reagiert mit Calciumcarbid und Calciumsulfid CAS und Kohle C:
CAC2 + S → 2 C + CAS
Die Schwefelentfernung wird bevorzugt, wenn das Mischen effizient und der Kohlenstoffgehalt in der Legierung niedrig ist. Casclium Calciumsulfid schwimmt auf der Oberfläche der geschmolzenen Legierung, wo es sich entscheidet und weggeworfen hat.
In mehreren Verwendungen
Kalziumkarbid wurde zur Eliminierung von Eisenschwefel verwendet. Auch als Kraftstoff bei der Herstellung von Stahl und als starkes Desoxidationsmittel.
Kann Ihnen dienen: aromatische elektrophile Substitution: Mechanismus und BeispieleEs wird verwendet, um Früchte zu reifen. Aus Kalziumkarbid mit Wasser wird Acetylen erzeugt, was die Reifung von Früchten wie Bananen induziert.
 Bananen können mit CAC Calciumcarbid reifen2. Autor: Alexas Fotos. Quelle: Pixabay.
Bananen können mit CAC Calciumcarbid reifen2. Autor: Alexas Fotos. Quelle: Pixabay. Calciumcarbid wird in falschen Kanonen verwendet, um das laute Explosionsgeräusch zu verursachen, das sie charakterisiert. Hier wird auch die Acetylenbildung verwendet, die mit einem Funken im Artefakt explodiert.
Der CAC2 Es wird verwendet, um Signale auf hoher See in Marinefackeln zu erzeugen, die sich selbst berücksichtigen.
Einsatzgebrauch
Der CAC2 Es wurde in den sogenannten Carbid -Lampen verwendet. Der Betrieb dieser besteht darin, Wasser auf Calciumcarbid zu tropfen.
Diese Lampen wurden in Kohleminen verwendet, ihre Verwendung wurde jedoch aufgrund des Vorhandenseins von Methangas -Cho abgesetzt4 In diesen Minen. Dieses Gas ist brennbar und die Flamme der Carbid -Lampe kann es feuern oder nutzen.
 CAC Calciumcarbid -Lampe2. Scehardt / Pub -Domäne. Quelle: Wikimedia Commons.
CAC Calciumcarbid -Lampe2. Scehardt / Pub -Domäne. Quelle: Wikimedia Commons. Sie wurden häufig in Schiefergesteinsminen, Kupfer und Zinn sowie in den ersten Autos, Motorrädern und Fahrrädern wie Frontlichtern oder Scheinwerfern eingesetzt.
Sie wurden derzeit durch elektrische Lampen oder sogar LED -Lampen ersetzt. Sie werden jedoch immer noch in Ländern wie Bolivien in Potosí Silver Mines eingesetzt.
Risiken
CAC Calciumcarbid2 Trocken ist nicht brennbar, aber in Gegenwart von Feuchtigkeitsformen Acetylen, was ist.
Ein Feuer in Gegenwart von CAC zu löschen2 Wasser, Schaum, Kohlendioxid oder Halogenlöscher sollten niemals verwendet werden. Natrium- oder Calciumhydroxid sollte verwendet werden.
Verweise
- Ropp, r.C. (2013). Gruppe 14 (C, Si, GE, Sn und Pb) Alkalische Erdverbindungen. Calciumcarbide. In Enzyklopädie der alkalischen Erdverbindungen. Von Scientedirect erholt.com.
- Pohanish, r. P. (2017). C. Carbid Calcium. In Sittigs Handbuch mit giftigen und gefährlichen Chemikalien und Karzinagenen (siebte Ausgabe). Von Scientedirect erholt.com.
- Sonne, h. et al. (2015). Eigenschaften von chemisch kombiniertem Calciumcarbid resultieren und ihre Inffektion von Zementeigenschaften. Materialien 2015, 8, 638-651. NCBI erholte sich.NLM.NIH.Regierung.
- Nie, Z. (2016). Öko-Materials und Lebenszyklusbewertung. Fallstudie: CO2 Emissionsanalyse von Calciumcarbidschlamm Klinker. In der grünen und nachhaltigen Herstellung von fortschrittlichem Material. Von Scientedirect erholt.com.
- Crundwell, f.K. Et al. (2011). Verfeinerte geschmolzene Ferronickel. Entfernungschwefel. In der extraktiven Metallurgie von Nickel-, Kobalt- und Platingruppenmetallen. Von Scientedirect erholt.com.
- Tressler, r.UND. (2001). Struktur- und Thermostrukturkeramik. Carbide. In Enzyklopädie der Materialwissenschaft und -technologie. Von Scientedirect erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- « 10 Vorteile des täglichen Laufens für die Gesundheit
- Moralische Werte Eigenschaften, Schulungen und Beispiele »

