Metallischer Charakter
- 1390
- 255
- Luca Holdt
Was ist der metallische Charakter??
Er Metallischer Charakter der Elemente Die Periodenzüchter bezieht sich auf alle variablen, chemischen und physikalischen, die Metalle definieren oder sie von anderen Naturs Substanzen unterscheiden. Sie sind normalerweise helle, dichte, harte, hohe thermische und elektrische, formbare und duktile Leitfähigkeiten.
Allerdings zeigen nicht alle Metalle solche Merkmale; Zum Beispiel im Fall von Quecksilber ist dies eine hell schwarze Flüssigkeit. Außerdem hängen diese Variablen von den terrestrischen Druck- und Temperaturbedingungen ab. Zum Beispiel kann sich anscheinend nicht -metallischer Wasserstoff bei extremen Bedingungen physisch als Metall verhalten.
Diese Bedingungen können sein: unter misergen Drücken oder sehr kalten Temperaturen um das absolute Null. Um zu definieren, ob ein Element metallisch ist oder nicht, müssen versteckte Muster in den Augen des Beobachters berücksichtigt werden: Atommuster.
Diese diskriminieren mehr Präzision und Zuverlässigkeit, was sind die Metallelemente und sogar welches Element metallischer als ein anderer ist.
Auf diese Weise beruht der wahre metallische Charakter einer Goldmünze mehr auf die Qualitäten seiner Atome als die, die durch ihre goldene Masse bestimmt werden, selbst beide sind eng miteinander verbunden.
Welcher der Münzen ist metallischer: eines von Gold, einer von Kupfer oder einem Platin? Die Antwort ist Platin, und die Erklärung liegt in seinen Atomen.
Wie variiert der metallische Charakter der Elemente in der Periodenzüchttabelle?
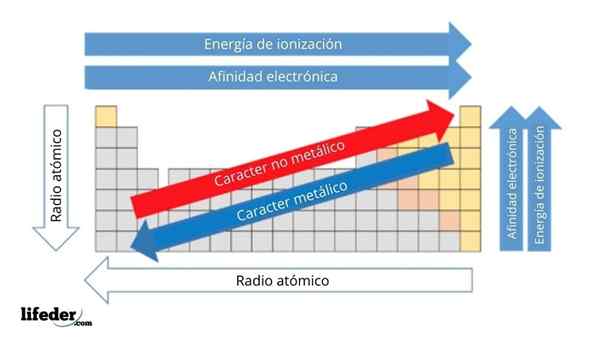
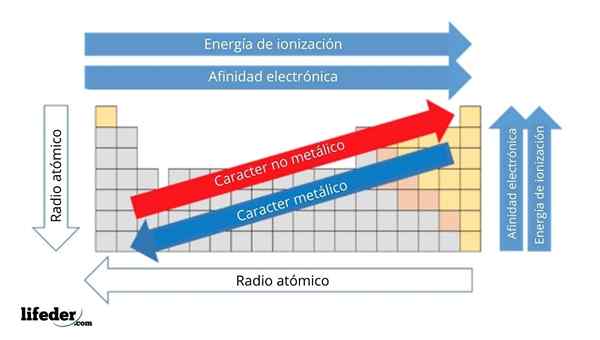
Im oberen Bild haben Sie die regelmäßigen Eigenschaften der Elemente. Die Zeilen entsprechen den Perioden und Spalten der Gruppen.
Der metallische Charakter nimmt von links nach rechts im Periodenzüchter ab und nimmt in die entgegengesetzte Richtung zu. Ebenso nimmt der metallische Charakter von oben nach unten zu und nimmt ab, wenn Perioden zu Gruppenköpfen gereist sind.
Es kann Ihnen dienen: Basen: Eigenschaften und BeispieleAuf diese Weise haben die Elemente, die in der Nähe der Richtung liegen, in die der Pfeil verweist, einen größeren metallischen Charakter als die in der entgegengesetzten Richtung (die gelben Blöcke), die sich befinden (die gelben Blöcke).
Darüber hinaus entsprechen die anderen Pfeile anderen periodischen Eigenschaften, die definieren, in welchem Sinne sie zunehmen oder abnehmen, wenn das Element "metallisch" ist. Zum Beispiel sind die Elemente der gelben Blöcke, obwohl sie einen niedrigen metallischen Charakter haben, ihre elektronische Affinität und Ionisierungsenergie hoch.
Im Falle von atomaren Radios ist das Element je größer, desto metallischer ist das Element; Dies wird durch den blauen Pfeil angezeigt.
Eigenschaften metallischer Elemente
In der Periodenzüchter wird beobachtet, dass Metalle große Atomradios, niedrige Ionisationsenergien, niedrige elektronische Affinitäten und niedrige Elektronegativitäten aufweisen. Wie man all diese Eigenschaften auswendig lernte?
Der Punkt, an den sie fließen, ist die Reaktivität (Elektropositivität), die Metalle definiert, die oxidieren; Das heißt, sie verlieren Elektronen leicht.
Wenn sie Elektronen verlieren, bilden Metalle Kationen (m+). Daher bilden die Elemente mit den höchsten metallischen Charakteren Kationen leichter als die von niedrigerem metallischem Charakter.
Ein Beispiel dafür ist die Reaktivität der Elemente der Gruppe 2, der Alkalinotaler -Metalle. Beryllium ist weniger metallisch als Magnesium, und dies wiederum ist weniger metallisch als Kalzium.
Also weiter, bis er den Metall Bario erreicht hat, das reaktivste der Gruppe (nach dem Radius, radioaktives Element).
Wie wirkt sich der Atomradius der Reaktivität von Metallen aus??
Wenn der Atomradius zunimmt.
Kann Ihnen dienen: Natriumhydroxid (NaOH): Struktur, Eigenschaften, Verwendungszwecke, SyntheseWenn jedoch eine Periode auf die rechte Seite des Periodenzüchtertabels gelangt ist, fügt der Kern Protonen zu seinem Körper hinzu, das jetzt positiver ist und die Valenzelektronen stärker anzieht und die Größe des Atomradius verringert. Dies führt zu einer Abnahme des metallischen Charakters.
Somit neigt ein sehr kleines Atom und mit einem sehr positiven Kern dazu, Elektronen zu gewinnen, anstatt sie zu verlieren (nicht -metallische Elemente), und solche, die sowohl Elektronen gewinnen als auch verlieren können, werden als Metalloides betrachtet. Bor, Silizium, Germanio und Arsen sind einige dieser Metalloiden.
Andererseits steigt der Atomradius auch, wenn andere Orbitale eine neue Energieverfügbarkeit vorliegen, was beim Abstieg in einer Gruppe auftritt.
Aus diesem Grund werden die Funkgeräte beim Abstieg in der Periodenzüchter sperrig und der Kern kann nicht in der Lage sein, andere Arten daran zu hindern, die Elektronen aus ihrer Außenschicht zu schnappen.
Im Labor mit einem starken oxidierenden Mittel verdünnte Salpetersäure (HNO3)- Metallreaktivitäten angesichts der Oxidation können untersucht werden.
In ähnlicher Weise sind die Bildungsprozesse ihrer Metallhalogenide (z. B. NaCl) auch demonstrative Experimente dieser Reaktivität.
Element des größeren metallischen Charakters
 Cäsium
Cäsium Die Richtung des blauen Pfeils im Bild des Periodensystems führt zum Francio- und Cesio -Elemente. Der Francio ist metallischer als das Cäsium, aber im Gegensatz zu letzteren ist der Francio künstlich und radioaktiv. Aus diesem Grund nimmt Cäsium den Ort des natürlichen Elements eines größeren metallischen Charakters ein.
Kann Ihnen dienen: EisenoxidTatsächlich ist eine der bekanntesten (und explosiven) bekannten Reaktionen diejenige, die auftritt, wenn ein Stück (oder Tropfen) von Cäsium mit Wasser in Kontakt kommt.
Die hohe Reaktivität der Cäsium, die auch in die Bildung viel stabilerer Verbindungen übersetzt ist, ist für die plötzliche Freisetzung von Energie verantwortlich:
2cs (s) + 2h2O → 2csoh (aq) + h2(G)
Die chemische Gleichung ermöglicht die Oxidation von Cäsium und die Verringerung von Wasserwasserstoff zu gasförmigen Wasserstoff.
Element des unteren metallischen Charakters
 3D -Fluormodell
3D -Fluormodell In der gegenüberliegenden Diagonale in der oberen rechten Ecke des Periodenzüchtertischs Fluorid (f)2, Überlegenes Bild) führt die Liste der nicht -metallischen Elemente an. Weil? Weil es das Element in der elektronegativsten Natur ist und das mit der niedrigsten Ionisationsenergie.
Mit anderen Worten, es reagiert mit allen Elementen der Periodenzüchter, um das Ion f zu bilden- und nicht f+.
Es ist sehr unwahrscheinlich, dass Fluor Elektronen in einer chemischen Reaktion verliert, was den Metallen widerspricht. Aus diesem Grund ist es das Element des unteren metallischen Charakters.
Verweise
- Lumen, Chemie für Nicht-Majors. Metallischer und nicht metalllischer Charakter. Von Kursen geborgen.Lumenarning.com
- Chemiezuordnung. (2018). Elektropostivität oder metallischer Charakter. Von der Chemieversorgung erholt.com
- Juan Ramos. Komplette Liste von Metallen und Nichtmetallen. Von ScienCetrends geborgen.com
- Anne Marie Helmestine, ph.D. Metallische Charaktereigenschaften und Trends. Von Thakedco erholt.com

