Katalaseeigenschaften, Struktur, Funktionen, Pathologien
- 3806
- 447
- Joe Hartwig
Der Katalase Es handelt sich. Katalysen in verschiedenen Geweben und Arten von Zellen, die „Zersetzung“ -Reaktion von Wasserstoffperoxid in molekularem Sauerstoff und Wasser.
Die ersten Beobachtungen dieser Art von Enzym stammen aus den frühen 1810er Jahren, aber 1901 erkannte Loew, dass Katalase in allen vorhandenen lebenden Organismen und in mehreren Arten verschiedener Zellen praktisch vorhanden ist.
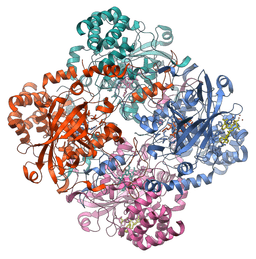
 Molekülstruktur des Katalaseenzyms (Quelle: Vossman [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Molekülstruktur des Katalaseenzyms (Quelle: Vossman [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Dieses Enzym, das für die Aufrechterhaltung der Zellintegrität und des Hauptregulators des Wasserstoffperoxidstoffwechsels von entscheidender Bedeutung ist, war ein grundlegender Faktor, um zu bestätigen, dass es in der Natur Enzyme gibt, die auf bestimmte Substrate wirken.
Säugetiere und andere Organismen haben Katalasenzyme, die sich auch wie Peroxidasen verhalten können, und katalysieren oxidierende Reaktionen verschiedener Substrate unter Verwendung von Wasserstoffperoxid.
In den meisten Eukaryoten befinden sich Katalasenzyme überwiegend in subzellulären Organellen, die als „Peroxisomen“ bekannt sind.
[TOC]
Eigenschaften
Die Aktivität von Enzymen wie Katalase kann je nach in Betracht gezogener Gewebetyp erheblich variieren. Bei Säugetieren beispielsweise ist die Katalaseaktivität sowohl in den Nieren als auch in der Leber signifikant und in Bindegeweben viel niedriger.
So dass Katalase bei Säugetieren hauptsächlich mit allen Geweben verbunden ist, die einen signifikanten aeroben Stoffwechsel haben.
Säugetiere haben Katalas sowohl in Mitochondrien als auch in Peroxisomen und in beiden Kompartimenten sind Enzyme, die mit Organelmembranen assoziiert sind. In Erythrozyten ist die Katalaseaktivität im Gegenteil mit einem löslichen Enzym verbunden (denken Sie daran, dass Erythrozyten knapp interne Organellen haben).
Kann Ihnen dienen: halb Stuart: Foundation, Vorbereitung und VerwendungKatalase ist ein Enzym mit einer hohen Anzahl von Ersatz- oder konstanter Katalyse (es ist sehr schnell und effizient), und die allgemeine Reaktion, die Katalysierung hat, lautet wie folgt:
2H2O2 → 2H2O + O2
In Gegenwart niedriger Konzentrationen von Wasserstoffperoxid verhält sich die Säugetierkatalase beispielsweise wie eine Oxidase unter Verwendung molekularer Sauerstoff (O2), um Moleküle wie Indol und β-Penylethylamin, Vorläufer der Tryptophan-Aminosäure und eines Neurotransmitters zu oxidieren.
Einige kompetitive Inhibitoren der Katalaseaktivität sind derzeit bekannt und unter ihnen stechen das Natrium und 3-Amynotriazol Azid heraus. Azida ist in seiner anionischen Form ein starker Inhibitor anderer Proteine mit Hämogruppen und wird zur Eliminierung oder Prävention des Wachstums des Mikroorganismens unter verschiedenen Bedingungen verwendet.
Struktur
Beim Menschen wird Katalase durch ein 34 -kb -Gen mit 12 Introns und 13 Exons und codiert, die für ein 526 Aminosäurerprotein kodiert werden.
Die Mehrheit der untersuchten Katalas sind tetramere Enzyme mit einem Molekulargewicht nahe 240 kDa (60 kDa für jede Untereinheit), und jedes Monomer ist mit einer Hemin- oder Ferroprrotoporfirin -prothetischen Gruppe assoziiert.
Seine Struktur besteht aus vier Domänen, die aus sekundären Strukturen bestehen, die von Alfa-Hellices und β-gepflegten Blättern gebildet werden, und Studien, die im Enzym der Leber von Menschen und Rindern durchgeführt wurden, haben gezeigt, dass diese Proteine mit vier NADPH-Molekülen verbunden sind.
Diese NADPH -Moleküle scheinen für die enzymatische Aktivität der Katalase (für die Produktion von Wasser und Sauerstoff aus Wasserstoffperoxid) nicht wesentlich zu sein, aber es scheint sich auf eine Abnahme der Anfälligkeit dieses Enzyms im Vergleich zu hohen Konzentrationen seines toxischen Substrats zu beziehen.
Die Domänen jeder Untereinheit in der Katalase des Menschen sind:
Kann Ihnen dienen: Carotinoide-Ein erweiterter nicht globulärer N-terminaler Arm, der zur Stabilisierung der quaternären Struktur wirkt
-Ein β-Barrel von acht β-Folds-Antiparallel, die der HEMO-Gruppe einige der lateralen Übergangsreste liefern
-Eine Domäne aus "Verpackung", die die äußere Domäne umgibt, einschließlich der HEMO -Gruppe und endlich
-Eine Domäne mit Alpha -Propellerstruktur
Die vier Untereinheiten mit diesen vier Domänen sind für die Bildung eines langen Kanals verantwortlich ).
Funktionen
Nach Ansicht einiger Autoren erfüllt Katalase zwei enzymatische Funktionen:
-Zersetzung von Wasserstoffperoxid in molekularem Wasser und Sauerstoff (als spezifische Peroxidase).
-Die Oxidation von Protonenspendern wie Methanol, Ethanol, vielen formischen Phenolen und Säure unter Verwendung eines Mol Wasserstoffperoxids (wie einer unspezifischen Peroxidase).
-In Erythrozyten scheint die große Katalasemenge eine wichtige Rolle beim Schutz von Hämoglobin vor Oxidationsmitteln wie Wasserstoffperoxid, Ascorbinsäure, Methylhydrazin und anderen zu spielen.
Das in diesen Zellen vorhandene Enzym ist für die Verteidigung anderer Gewebe mit wenig Katalaseaktivität im Vergleich zu hohen Konzentrationen an Wasserstoffperoxid verantwortlich.
-Einige Insekten wie die Bomberkäfer verwenden Katalase als Abwehrmechanismus, da Wasserstoffperoxid sich zersetzt und gasförmige Sauerstoffprodukte der Reaktion verwendet.
-In Pflanzen ist Katalase (auch in Peroxisomen vorhanden) eine der Komponenten des Photorerspirationsmechanismus, bei dem das vom Rubisco-Enzym erzeugte Phosphoglycat zur Produktion von 3-Phosphoglyzerat verwendet wird.
Kann Ihnen dienen: Loos -ZyklusVerwandte Pathologien beim Menschen
Die Hauptproduktionsquellen des Katalasesubstrats Wasserstoffperoxid sind die Reaktionen, die durch Oxidase -Enzyme, reaktive Sauerstoffspezies und einige Tumorzellen katalysiert wurden.
Diese Verbindung ist an entzündlichen Prozessen, an der Expression von adhäsiven Molekülen, an der Apoptose, bei der Regulation der Thrombozytenaggregation und bei der Kontrolle der Zellproliferation beteiligt.
Wenn es Mängel dieses Enzyms gibt, werden hohe Konzentrationen seines Substrats erzeugt, die Läsionen in der Zellmembran, Defekte des elektronischen Transports in Mitochondrien, im Stoffwechsel von Homocystein und in DNA erzeugen.
Unter den Krankheiten, die mit Mutationen im kodierenden Gen für die Katalase des Menschen verbunden sind, können erwähnt werden:
-Mellitus Diabetes
-Arterieller Hypertonie
-Alzheimer
-Vitiligo und andere
Verweise
- Agar, n., Sadrzadeh, s., Findo, p., & Eaton, J. (1986). Erythrozyten -Katalase. Eine somatische Oxidationsmittelverteidigung? J. Klinik. Investieren., 77, 319-321.
- Góth, l., Rass, p., & Páy, zu. (2004). Katalase -Enzymmutationen und deren Assoziation mit Designs. Molekulare Diagnose, 8(3), 141-149.
- Kirkman, h., & Gaetanit, G. F. (1984). Katalase: ein tetramerisches Enzym mit vier eng gebundenen Nadph -Molekülen. Proc. Natl. Acade. Sci. VERWENDET, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, G. F. (2006). Säugetierkatalase: Ehrbares Enzym mit neuen Geheimnissen. Trends in biochemischen Wissenschaften, 32(1), 44-50.
- Rawn, j. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Solomon, e., Berg, l., & Martin, D. (1999). Biologie (5. Aufl.). Philadelphia, Pennsylvania: Saunders College Publishing.
- Vinshtein, geb., Melik-Adamyan, w., Barynin, v., Vagin, a., & Grvenko, a. (1981). Dreidimensionale Struktur der Enzymkatalase. Natur, 293(1), 411-412.
- « Lacasas -Eigenschaften, Struktur, Funktionen
- Gleichmäßig beschleunigte geradlinige Bewegungseigenschaften, Formeln, Formeln »

