Trainingskation, Unterschiede mit Anion und Beispielen

- 1272
- 189
- Ibrahim Steuk
A Kation Es ist eine chemische Spezies, die eine positive Ladung hat. Die beiden Arten bestehender Ionen sind für den Anion. Seine Last ist das Produkt eines Elektronenmangels im Atom, wodurch die Kernprotonen eine größere Anziehungskraft ausüben. Für jedes Elektron, das ein neutrales Atom verliert, wird die positive Belastung in einer Einheit erhöht.
Wenn ein Atom ein Elektron verliert und daher die Anzahl der Protonen größer als eins ist, beträgt die positive Belastung +1; Wenn Sie zwei Elektronen verlieren, beträgt die Last +2 und so weiter. Wenn ein Kation eine Last von +1 hat, soll es ein monovalentes sein; Wenn andererseits die Last größer als +1 ist, wird gesagt, dass das Kation vielseitig ist.
 Hydronio -Ion, eines der einfachsten Kationen Kationen. Quelle: Gabriel Bolívar.
Hydronio -Ion, eines der einfachsten Kationen Kationen. Quelle: Gabriel Bolívar. Im oberen Bild wird Kation h gezeigt3ENTWEDER+, Hydronio -Ion genannt. Wie zu sehen ist, hat es kaum eine Last +1, gemäß einem einwerfenden Kation.
Kationen sind wichtige Arten, da sie mit ihrer Umgebung und den Molekülen eine elektrostatische Kraft ausüben. Sie haben eine hohe Wechselwirkung mit Wasser, Flüssigkeit, die sie in feuchten Böden hydratisiert und transportiert, und erreichen dann die Wurzeln der Pflanzen und werden für ihre physiologischen Funktionen verwendet.
[TOC]
Wie wird ein Kation gebildet??
Es wurde erwähnt, dass, wenn ein Atom ein Elektron verliert, seine größte Anzahl von Protonen in Bezug auf Elektronen eine Anziehungskraft ausübt, die zu einer positiven Belastung führt. Aber wie kann Elektronenverlust auftreten?? Die Antwort hängt von der Transformation ab, die bei chemischen Reaktionen aufgetreten ist.
Es ist zu beachten, dass das Vorhandensein eines Atoms mit positiver Belastung nicht unbedingt die Bildung eines Kationen impliziert. Damit es als solches betrachtet werden kann, sollte es kein Atom mit einer negativen formalen Belastung geben, die neutralisiert wird. Andernfalls würde es in derselben Verbindung Anziehung und Abstoßung geben und neutral sein.
Kann Ihnen dienen: Calciumsulfat (Fall4): Chemische Struktur, Eigenschaften, verwendetFormelle Gebühren und mehr Links
Elektronegative Atome ziehen die Elektronen ihrer kovalenten Bindungen an sie an. Obwohl Elektronen gleichermaßen geteilt werden, gibt es einen Punkt, an dem sie teilweise weniger Elektronen haben als in ihrer Basalkonfiguration. Dies ist das ihrer freien Atome, ohne mit anderen Elementen verbunden zu sein.
Dann werden diese elektronegativen Atome anfangen, einen Elektronenmangel zu erleben, und damit werden die Protonen ihrer Kerne eine Kraft einer größeren Anziehungskraft ausüben. Die positive formale Last wird geboren. Wenn es nur eine positive formale Belastung gibt, zeigt die Verbindung eine globale positive ionische Belastung; So wurde das Kation geboren.
Das Sauerstoffatom von Kation H3ENTWEDER+ Es ist ein treues Beispiel des oben genannten. Durch drei O-H-Bindungen erlebt ein mehr als im Wassermolekül (H-O-H) den Verlust eines Elektrons in Bezug auf seinen Grundzustand. Die Berechnungen der formalen Lasten ermöglichen zu, in diesem Fall zu bestimmen.
Wenn die Bildung eines anderen O-H für einen Moment angenommen wird, wird das zweiwertige Kation erhalten4ENTWEDER2+. Beachten Sie, dass die auf dem Kation auf dem Kation geschriebene Anlastung wie folgt geschrieben ist: Die Nummer folgte dem Symbol "+"; Ebenso werden die Anionen fortgesetzt.
Oxidation
Metalle sind Kationenformatoren par excellence. Allerdings kann nicht jeder kovalente Bindungen bilden (oder zumindest rein kovalent). Stattdessen verlieren sie Elektronen, um ionische Bindungen festzulegen: Eine positive Belastung zieht ein negativ.
Daher verlieren Metalle Elektronen, um von m nach m zu wechselnN+, Wo N Es entspricht normalerweise der Anzahl Ihrer Gruppe in der Periodenzüchtertabelle. Obwohl N Sie können mehrere ganze Werte nehmen, was insbesondere bei Übergangsmetallen auftritt. Dieser Elektronenverlust erfolgt in einer Art chemischer Reaktion, die als Oxidation bezeichnet wird.
Kann Ihnen dienen: Tertiäralkohol: Struktur, Eigenschaften, BeispieleDie Metalle oxidieren, verlieren ein Elektron, die Anzahl der Protonen ihrer Atome übersteigt die der Elektronen und weisen folglich eine positive Belastung auf. Damit es Oxidation gibt, muss es ein Oxidationsmittel geben, das Elektronen reduziert oder gewinnt, die durch Metalle verloren gehen. Sauerstoff ist das bekannteste Oxidationsmittel von allen.
Unterschiede mit Anion
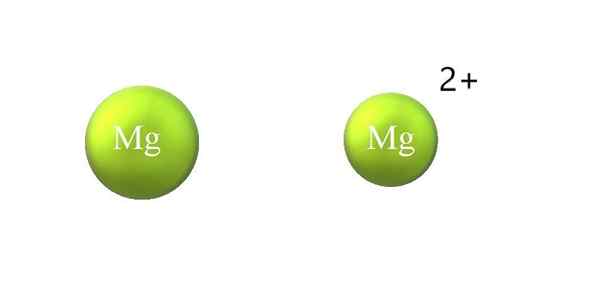 Atomradiuskontraktion in einem Kation. Quelle: Gabriel Bolívar.
Atomradiuskontraktion in einem Kation. Quelle: Gabriel Bolívar. Im Folgenden finden Sie die Unterschiede zwischen einem Kation und einem Anion:
-Das allgemeine Kation ist kleiner als Anion. Das obere Bild zeigt, wie der Atomradius des Mg durch Verlust von zwei Elektronen und zum MG -Kation reduziert wird2+; Das Gegenteil tritt bei Anionen auf: Sie werden sperriger.
-Es hat mehr Protonen als Elektronen, während Anion mehr Elektronen als Protonen hat.
-Seine Lastdichte ist kleiner und weist daher eine größere polarisierende Kraft auf. das heißt, verformt sich die elektronischen Wolken benachbarter Atome.
-Ein Kation bewegt sich in die gleiche Richtung wie das des angelegten elektrischen Feldes, während das Anion dies in der entgegengesetzten Richtung tut.
Beispiele für die häufigsten Kationen
Monoatomisch
Monoatomische Kationen stammen hauptsächlich aus Metallen (mit Ausnahme bestimmter Ausnahmen wie H+). Von den anderen ist es äußerst selten, ein Kation zu betrachten, das von einem nicht -metallischen Element abgeleitet ist.
Es ist zu sehen, dass viele von ihnen DI oder vielseitig sind und dass die Größen ihrer Lasten der Anzahl ihrer Gruppen in der Periodenzüchttabelle übereinstimmen.
Es kann Ihnen dienen: Ribulosa-1,5-Biphosphat (RUBP): Eigenschaften, Carbolixation-Li+
-N / A+
-K+
-Rb+
-CS+
-Fr+
-Ag+
Alle haben gemeinsam die Ladung '1+', die ohne Platzierung der Anzahl geschrieben ist, und stammen auch aus Gruppe 1: Alkalische Metalle. Außerdem gibt es die Kation AG+, Eines der häufigsten Übergangsmetalle.
-Sei2+
-Mg2+
-AC2+
-Herr2+
-Ba2+
-Ra2+
Diese zweiwertigen Kationen stammen aus ihren jeweiligen Metallen, die zu Gruppe 2 gehören: Alkalinerior -Metalle.
-Zum3+
-Ga3+
-In3+
-Tl3+
-NH3+
Treiberkationen der Boro -Gruppe.
Bisher wurden die Beispiele durch eine einzelne Valenz oder Belastung gekennzeichnet. Andere Kationen weisen mehr als einen Valenz- oder positiven Oxidationszustand auf:
-Sn2+
-Sn4+ (Zinn)
-CO2+
-CO3+ (Kobalt)
-Au+
-Au3+ (Gold)
-Glaube2+
-Glaube3+ (Eisen)
Und andere Metalle wie Mangan können noch viele weitere Valences haben:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Je größer die Last, kleiner und polarisierend ist, ist das Kation.
Polyiatom
Ohne in die organische Chemie zu gehen, gibt es anorganische und polylamische Kationen, die im täglichen Leben sehr häufig sind. wie zum Beispiel:
-H3ENTWEDER+ (Hydronio, bereits erwähnt).
-NH4+ (Ammonium).
-NEIN2+ (Nitronio, in Nitrationsprozessen vorhanden).
-PH4+ (Phosphonium).
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Helmestine, Anne Marie, ph.D. (5. Mai 2019). Definition und Beispielkation. Erholt von: thoughtco.com
- Wyman Elizabeth. (2019). Kation: Definition & Beispiel. Lernen. Erholt von: Studium.com
- Dummies. (2019). Positive und negative Ins: Kationen und Anionen. Erholt von: Dummies.com
- Wikipedia. (2019). Kation. Geborgen von: ist.Wikipedia.Org
- « Anisolstruktur, Eigenschaften, Nomenklatur, Risiken und Verwendung
- Archäolithischer Herkunft, Eigenschaften, Klima, Flora und Fauna »

