Galvanische Zellteile, Wie funktioniert, Anwendungen, Beispiele

- 2585
- 138
- Joy Hort
Der Galvanische Zelle o voltaische Zelle ist eine Art elektrochemischer Zelle, die aus zwei verschiedenen Metallen besteht.
Dann wird eine der Metalle in einem der Semi -Bllads oxidiert, während das Metall der anderen Halbmedien reduziert wird, wodurch ein Elektronenaustausch durch einen externen Stromkreis erzeugt wird. Dies ermöglicht es, den elektrischen Strom zu nutzen.
 Abbildung 1. Schema und Teile einer galvanischen Zelle. Quelle: Korinth.PUCP.Edu.Sport.
Abbildung 1. Schema und Teile einer galvanischen Zelle. Quelle: Korinth.PUCP.Edu.Sport. Der Name "Galvanic Cell" ist zu Ehren eines der Pioniere des Experimentierens mit Elektrizität: des italienischen Arztes und Physiologen Luigi Galvani (1737-1798).
Galvani entdeckte 1780, dass, wenn sie sich durch ein Endkabel verschiedener Metalle anschließen und die freien Enden mit dem ANCA eines Frosches (tot) in Kontakt gebracht wurden, eine Kontraktion aufgetreten ist.
Der erste, der eine elektrochemische Zelle zur Erzeugung von Strom baute.
Teile der galvanischen Zelle
Die Teile einer galvanischen Zelle sind in Abbildung 1 dargestellt und sind folgende:
1.- Anodische Halbmedien
2.- Anodiumelektrode
3.- Anodische Lösung
4.- Cathodic Semi -Media
5.- Kathodische Elektrode
6.- Kathodische Lösung
7.- Salzbrücke
8.- Metallic Leiter
9.- Voltmeter
Funktion
Um das Funktionieren einer galvanischen Zelle zu erklären, werden wir uns auf die untere verlassen:
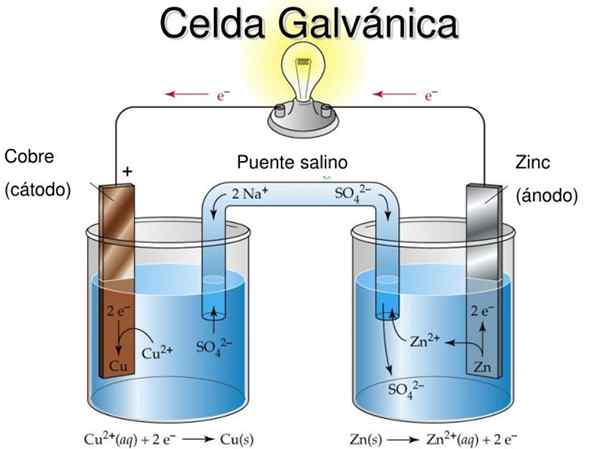 Figur 2. Galvanische Zelldidaktische Modell. Quelle: Slideserve.com
Figur 2. Galvanische Zelldidaktische Modell. Quelle: Slideserve.com Die grundlegende Idee einer galvanischen Zelle ist, dass das Metall, das unter der Oxidationsreaktion leidet Zum Beispiel, um eine Glühbirne oder LED anzündeten.
In Abbildung 2 in der semi -media links haben Sie ein metallisches Kupferband (CU) in eine Kupfersulfatlösung (CUS0) eingetaucht4) Während im rechten Semi -LID ein Zinkband (Zn) in einer Zinksulfatlösung (ZnSO) befindet4).
Es ist zu beachten, dass in jedem Halbmedien das Metall von jedem in zwei Oxidationszuständen vorhanden ist: die neutralen Metallatome und die Metallionen des Salzes desselben Metalls in Lösung.
Wenn die Metallbänder nicht durch ein Außenleitkabel verbunden sind, oxidieren beide Metalle in ihren jeweiligen Zellen getrennt.
Wenn es jedoch elektrisch angeschlossen ist. Dies liegt daran, dass der Oxidationsgrad von Zink größer ist als der von Kupfer.
Das Metall, das oxidiert.
Kann Ihnen dienen: halogenierte DerivateOxidations- und Reduktionsreaktionen
Die Reaktion, die auf der rechten Seite zwischen der Zinkmetallelektrode und der wässrigen Zinksulfatlösung auftritt, ist wie folgt:
Znentweder(S) + Zn2+ (SW4)2- → 2 Zn2+(Ac) + (SW4)2- + 2 e-
Ein Atom von Zink (fest) auf der Oberfläche der anodischen Elektrode im halb -der -recht als positives Doppelion von Zink.
Wir haben festgestellt, dass das Nettoergebnis darin bestand, dass ein Atom von neutralem Metallzink durch Verlust von zwei Elektronen zu einem Ion von Zink wurde, das zur wässrigen Lösung beiträgt, so dass der Zinkstangen ein Atom verlor und die Lösung ein positives Doppel -Ion erwarb.
Freigezogene Elektronen werden es vorziehen, sich durch das externe Kabel in Richtung Metall der anderen Halbmedien mit positiver Belastung zu bewegen (Cartodo +). Die Zinkstange verliert die Masse, da ihre Atome allmählich zur wässrigen Lösung gelangen.
Zinkoxidation kann wie folgt zusammengefasst werden:
Znentweder(S) → Zn2+(Ac) + 2 e-
Die auf der linke Seite auftretende Reaktion ist ähnlich, aber das Kupfer der wässrigen Lösung erfasst zwei Elektronen (stammt aus dem anderen halbmotiven) und wird in der Kupferelektrode abgelagert. Wenn ein Atom Elektronen erfasst, soll es reduziert werden.
Die Kupferreduktionsreaktion ist so geschrieben:
Cu2+(Ac) + 2 e- → cuentweder(S)
Die Kupferstange gewinnt Teig, da die Ionen der Lösung an die Stange gehen.
Oxidation tritt in der Anode (negativ) auf, die Elektronen abweist, während die Reduktion in der Kathode (positiv) auftritt, was Elektronen anzieht. Der Elektronenaustausch erfolgt über den externen Treiber.
Die Salzbrücke
Die Kochsalzlösung gleicht die Lasten aus, die sich in den beiden Semi -Lies ansammeln. In den anodischen halbdiad -positiven Ionen sammeln sich an, während im kathodischen.
Für die Salzbrücke wird eine Lösung eines Salzes (wie Natriumchlorid oder Kaliumchlorid) verwendet, das nicht in die Reaktion eingeht, die sich in einem umgekehrten U -fischten Röhrchen befindet, wobei die Enden mit einer Wand aus poröses Material verstopft sind.
Der einzige Zweck der Kochsalzlösung besteht darin, dass die Ionen für jede Zellausgleich oder Neutralisierung der überschüssigen Last filtriert werden,. Somit gibt es durch die Salzbrücke einen Stromfluss durch die Kochsalzlösung, die den elektrischen Schaltkreis schließt.
Oxidations- und Reduktionspotentiale
Standard -Oxidations- und Reduktionspotentiale werden verstanden.
Es kann Ihnen dienen: Scandio: Geschichte, Eigenschaften, Reaktionen, Risiken und VerwendungFür Zink ist sein Standard -OxidationspotentialOchse = +0,76 v. Inzwischen ist das Standard -Reduktionspotential für Kupfer und undNetz = +0,34 v. Die von dieser galvanische Zelle erzeugte elektromotive Kraft (FEM) lautet: FEM = +0,76 V + 0,34 V = 1,1 V.
Die globale Reaktion der galvanischen Zelle kann so geschrieben werden:
Znentweder(S) + Cu2+(Ac) → Zn2+(Ac) + Cuentweder(S)
Berücksichtigung der Nettoreaktion ist:
Znentweder(S) + Cu2+ (SW4)2- 25ºC → Zn2+ (SW4)2-+ Cuentweder(S)
Sulfat ist ein Zuschauer, während Metalle Elektronen austauschen.
Symbolische Darstellung einer galvanischen Zelle
Die galvanische Zelle von Abbildung 2 wird symbolisch wie folgt dargestellt:
Znentweder(S)| Zn2+(Ac) (1m) || Cu2+(Ac) (1m) | cuentweder(S)
Durch Konvent. Das anodische Halbmedium wird durch zwei Balken (||) vom kathodischen getrennt, der die Kochsalzlösungsbrücke darstellt. Rechts wird das Metall -Semi -Medium reduziert und bildet die Kathode (+).
In der symbolischen Darstellung einer galvanischen Zelle ist das Ende immer das Metall, das oxidiert, und am Ende wird das Metall (im festen Zustand) platziert, das reduziert wird. Es ist zu beachten, dass in Abbildung 2 die Halbschalter in Bezug auf herkömmliche symbolische Darstellung umgekehrt sind.
Anwendungen
Bekannt die Standard -Oxidationspotentiale verschiedener Metalle Es ist möglich, die elektromotive Kraft zu bestimmen, die mit diesen Metallen einen galvanischen Stapel erzeugt.
In diesem Abschnitt gilt das oben genannte in den vorherigen Abschnitten, um die elektromotorische Netto -Kraft einer mit anderen Metallen gebauten Zellen zu berechnen.
Als Beispiel für die Anwendung betrachten wir eine galvanische Eisenzelle (Glaube) und Kupfer (CU). Als Daten werden die folgenden Reduktionsreaktionen und sein Standard -Reduktionspotential angegeben, dh bei 25 ° C und 1M Konzentration:
Glaube2+(Ac) + 2 e- → Glaube(S). E1Netz = -0,44 v
Cu2+(Ac) + 2 e- → cu(S). E2Netz = +0,34 v
Es wird gebeten, die von der folgende galvanische Zelle erzeugte Nettoelektromotorkraft zu finden:
Glaube(S)| Glaube2+(Ac)(1m) || cu2+(Ac)| Cu(S)
In diesem Stapel ist das Eisen oxidierend und ist die Anode der galvanischen Zelle, während das Kupfer reduziert wird und die Kathode ist. Das Eisenoxidationspotential ist das gleiche, aber im Gegensatz zu seinem Reduktionspotential bedeutet das heißt E1Oxd = +0,44.
Um die von dieser galvanische Zelle erzeugte elektromotive Kraft zu erhalten, fügen wir das Eisenoxidationspotential mit dem Kupferreduktionspotential hinzu:
Kann Ihnen dienen: Stickstoffoxide (NOx)fem = e1Oxd + E2Netz = -E1Netz + E2Netz = 0,44 V + 0,34 V = 0,78 V.
Galvanische Zelle im täglichen Leben
Galvanische Zellen für den täglichen Gebrauch sind weit entfernt von der Form, die als didaktisches Modell verwendet wird, aber ihr Betriebsprinzip ist das gleiche.
Die am häufigsten verwendete Zelle ist eine alkalische Batterie von 1,5 V in ihren verschiedenen Präsentationen. Der Vorname kommt, weil es sich um eine Reihe von Zellen handelt, die in Reihe verbunden sind, um die Fem zu erhöhen.
Wiederaufladbare Lithiumbatterien basieren auch auf dem gleichen Betriebsprinzip von galvanischen Zellen und werden in Smartphones, Uhren und anderen Geräten verwendet.
Ebenso sind die Bleibatterien von Autos, Motorrädern und Booten 12 V und basieren auf demselben Betriebsprinzip der galvanischen Zelle.
Galvanische Zellen werden in Ästhetik und Muskelregeneration verwendet. Es gibt Gesichtsbehandlungen, die aus dem Auftragen von Strom durch zwei Elektroden in Form einer Walze oder Kugel bestehen, die die Haut reinigen und tonigieren.
Aktuelle Impulse gelten auch, um die Muskulatur bei Menschen, die sich in einem Zustand der Niederwerfung befinden, zu regenerieren.
Bau einer hausgemachten galvanischen Zelle
Es gibt viele Möglichkeiten, eine hausgemachte galvanische Zelle zu bauen. Einer der einfachsten ist es, Essig als Lösung, Stahlnägel und Kupferkabel zu verwenden.
Materialien
-Einweg -Plastikgefäße
-Weißweinessig
-Zwei Stahlschrauben
-Zwei Stücke nackter Kupferdraht (ohne Isolier oder Lack)
-Ein Voltmeter
Verfahren
-Füllen Sie ¾ Teile des Glass mit Essig.
-Verbinden Sie die beiden Stahlschrauben mit mehreren Drahtbogen und lassen ein Stück Draht ohne Wicklung.
Das endlose Ende des Kupferkabel.
 Figur 3. Hausgemachte galvanische Zelle und Multimeter. Quelle: YouTube.com
Figur 3. Hausgemachte galvanische Zelle und Multimeter. Quelle: YouTube.com Ein weiteres Stück Kupferkabel wird ebenfalls in einen Umkehrten gefaltet und hängt an der Kante des Glass in einer diametral entgegengesetzten Position zu den untergetauchten Schrauben das Glas.
Die freien Enden der Voltmeterkabel sind angeschlossen, um die von dieser einfache Zelle erzeugte elektromotive Kraft zu messen. Das FEM dieser Art von Zellen beträgt 0,5 V. Um der FEM einer alkalischen Batterie zu entsprechen
Verweise
- Borneo, r. Galvanische und elektrolytische Zellen. Abgerufen aus: Quimica -Klassen.Blogspot.com
- Cedrón, j. Allgemeine Chemie. PUCP. Erholt von: Korinth.PUCP.Edu.Sport
- Farrera, l. Einführung in die Elektrochemie. Abteilung der Unam Physikochemie. Erholt von: Depa.Fquim.Unam.mx.
- Wikipedia. Elektrochemische Zelle. Geborgen von: ist.Wikipedia.com.
- Wikipedia. Galvanische Zelle. Geborgen von: ist.Wikipedia.com.

