Elektrochemische Zellen

- 3923
- 664
- Nick Laurén
Was sind elektrochemische Zellen?
Der Elektrochemische Zellen Es handelt sich um Geräte, in denen chemische Reaktionen passieren, wenn chemische Energie in Strom umgewandelt wird oder umgekehrt. Diese Zellen bilden das Herz der Elektrochemie, wobei die Seele der potenzielle Austausch von Elektronen ist, der spontan oder nicht spontan zwischen zwei chemischen Spezies auftreten kann.
Einer der beiden Arten oxidiert, verliert Elektronen, während das andere durch Gewinn der abgesetzten Elektronen reduziert wird. Häufig ist die reduzierte Spezies ein metallisches Kation in Lösung, das durch elektrisch elektrisch auf einer Elektrode aus demselben Metall elektrisch gewinnt. Andererseits sind die Spezies, die oxidiert.
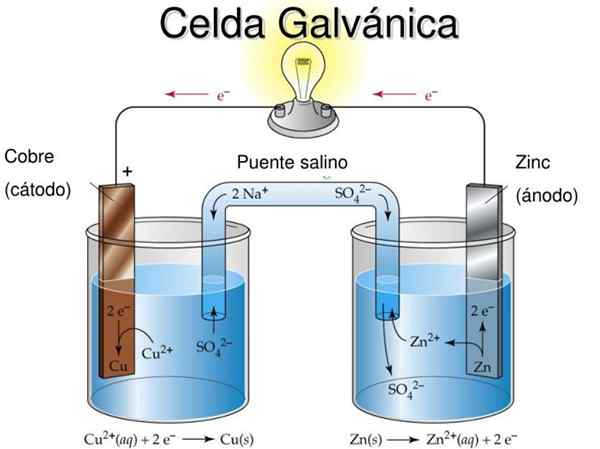
 Daniels elektrochemischer Zelldiagramm. Quelle: revhua [cc by (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Daniels elektrochemischer Zelldiagramm. Quelle: revhua [cc by (https: // creativecommons.Org/lizenzen/bis/3.0)]] Zum Beispiel repräsentiert das überlegene Bild Daniels Zelle: das einfachste aller elektrochemischen Zellen. Die metallische Zinkelektrode wird oxidiert und freisetzt Zn -Kationen2+ zur wässrigen Umgebung. Dies tritt im ZnSO -Behälter auf4 von links.
Rechts die Lösung, die Cuo enthält4 Es ist reduziert und transformiert Kationen Cu2+ In metallischem Kupfer, das auf der Kupferelektrode abgelagert wird. Während der Entwicklung dieser Reaktion bewegt sich Elektronen einen externen Schaltkreis, der ihre Mechanismen aktiviert. Und daher Strom für den Betrieb einer Ausrüstung liefern.
Elektrochemische Zellkomponenten
Elektroden
In elektrochemischen Zellen werden erzeugt oder verbraucht. Um einen ordnungsgemäßen Elektronenfluss zu gewährleisten, müssen Materialien gute Stromleiter bestehen. Hier kommen Elektroden und externe Schaltkreise, die mit Kupferkabel, Silber oder Gold versehen sind.
Die Elektroden sind die Materialien, die die Oberfläche liefern, an der Reaktionen in elektrochemischen Zellen entwickelt werden. Es gibt zwei Arten entsprechend der Reaktion, die in ihnen auftritt:
- Anode, Elektrode, bei der Oxidation auftritt.
- Kathode, Elektrode, bei der die Reduktion auftritt.
Die Elektroden können aus einem reagierenden Material bestehen, wie bei Daniels Zelle (Zink und Kupfer); oder aus einem inerten Material, wie es bei Platin oder Graphit der Fall ist.
Von der Anode zugewiesene Elektronen müssen die Kathode erreichen. Aber nicht durch eine Lösung, sondern ein metallisches Kabel, das beide Elektroden zu einem externen Stromkreis verbindet.
Elektrolytauflösung
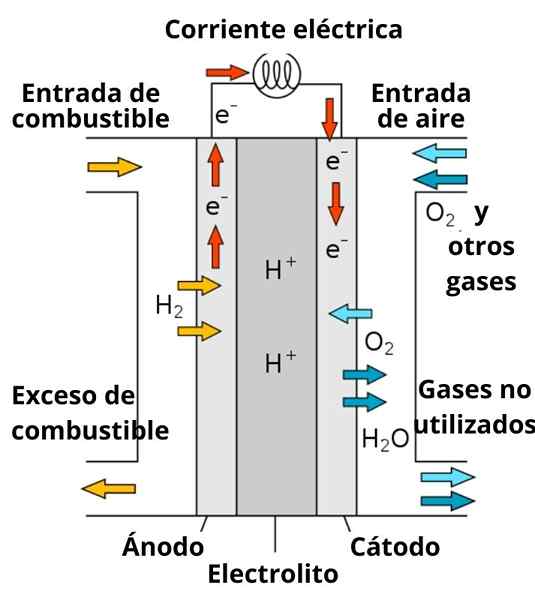 Schema einer Protonen -Leitleistung Kraftstoffbatterie
Schema einer Protonen -Leitleistung Kraftstoffbatterie Die Auflösung, die die Elektroden umgibt, spielt auch eine wichtige Rolle, da sie mit starken Elektrolyten angereichert ist. wie: kcl, Kno3, NaCl usw. Diese Ionen bevorzugen in gewissem Maße die Migration von Elektronen von der Anode in die Kathode sowie ihre Leitung durch die Nähe der Elektroden, um mit den Spezies zu interagieren, um sie zu reduzieren.
Das Meerwasser führt zum Beispiel viel besserer Strom als destilliertes Wasser mit niedrigerer Ionenkonzentration. Deshalb haben elektrochemische Zellen eine Lösung starker Elektrolyte zwischen ihren Komponenten.
Salzbrücke
Die Ionen der Lösung beginnen, die Elektroden zu umgeben, was zu einer Polarisation der Lasten führt. Die Auflösung um die Kathode beginnt sich negativ zu laden, wenn Kationen reduziert werden. Im Fall von Daniels Zelle, Cu -Kationen2+ Durch die Einzahlung als metallisches Kupfer auf der Kathode. Somit gibt es ein Defizit von positiven Gebühren.
Hier interveniert die Salzbrücke, um die Lasten auszugleichen und zu verhindern, dass die Elektroden polarisiert werden. An der Seite oder dem Fach der Kathodenkationen der Salzbrücke wandert entweder k+ oder Zn2+, Die Cu ersetzen2+ verbraucht. In der Zwischenzeit wird von der Salzbrücke Anionen nicht migrieren3- In Richtung des Anodenkompartiments, um die wachsende Konzentration von Zn -Kationen zu neutralisieren2+.
Es kann Ihnen dienen: Kaliumdichromat: Formel, Eigenschaften, Risiken und VerwendungDie Salzbrücke besteht aus einer gesättigten Salzlösung, wobei ihre Enden von einem durchlässigen Ionengel bedeckt sind, aber wasserdicht für Wasser.
Arten von elektrochemischen Zellen und wie sie funktionieren
Die Art und Weise, wie eine elektrochemische Zelle funktioniert. Es gibt grundsätzlich zwei Arten: galvanisch (oder voltaisch) und elektrolytisch
Galvanik
Daniels Zelle ist ein Beispiel für eine galvanische Elektrochemiezelle. In ihnen treten die Reaktionen spontan auf und das Potenzial der Batterie ist positiv. Je größer das Potenzial ist, desto größer ist der Strom, der die Zelle liefert.
Die Batterien oder Batterien sind genau galvanische Zellen: Das chemische Potential zwischen den beiden Elektroden wird in elektrische Energie umgewandelt, wenn ein externer Schaltkreis eingreift, der sie verbindet. So migrieren Elektronen aus der Anode, zünden Sie die Ausrüstung an, an die die Batterie angeschlossen ist, und werden direkt an die Kathode zurückgegeben.
Elektrolyt
Elektrolytische Zellen sind solche, deren Reaktionen nicht spontan auftreten, es sei denn, sie werden durch elektrische Energie aus einer externen Quelle geliefert. Hier tritt das entgegengesetzte Phänomen auf: Elektrizität ermöglicht es zu entwickelnde chemische Reaktionen.
Eine der bekanntesten und wertvollen Reaktionen, die in dieser Art von Zellen stattfinden, ist die Elektrolyse.
Wiederaufladbare Batterien sind Beispiele für Elektrolyt- und gleichzeitig galvanischer.
Beispiele
Daniels Zelle
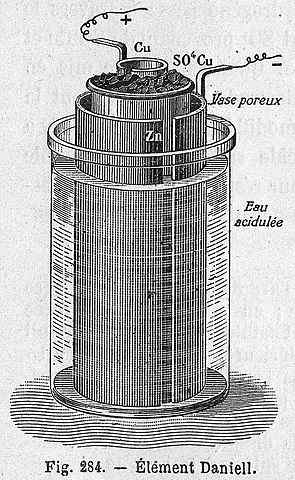 Daniels Zellschema
Daniels Zellschema Die folgende chemische Gleichung entspricht der Reaktion von Daniels Zelle, an der Zink und Kupfer teilnehmen:
Kann Ihnen dienen: Miet -Halogenuros: Eigenschaften, erhalten, BeispieleZn (s) + cu2+(aq) → Zn2+(aq) + cu (s)
Aber Cu -Kationen2+ und Zn2+ Sie sind nicht allein, sondern von den SO -Anionen begleitet42-. Diese Zelle kann wie folgt dargestellt werden:
Zn | ZnSO4 | | Cuso4 | Cu
Daniels Zelle kann in jedem Labor gebaut werden und ist als Praxis in der Einführung der Elektrochemie sehr wiederkehrend. Als cu2+ Es wird als Cu abgelagert, die blaue Farbe der Cuso -Lösung4 Es wird verloren gehen.
Platin und Wasserstoffzelle
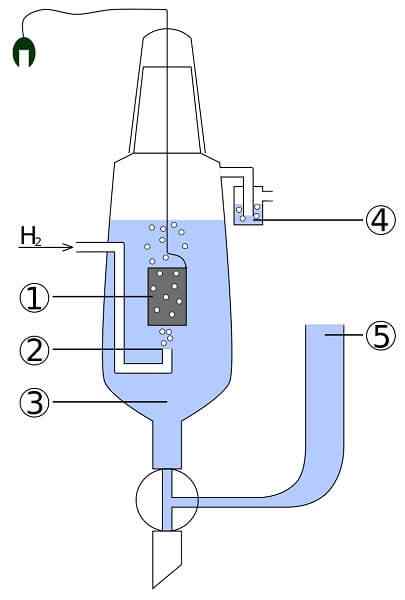 Schema einer Platin und Wasserstoffzelle: 1. 2 Platinelektrode. Wasserstoffgas 3. Säurelösung 4. Hidroseal 5. Einzahlung der Gewerkschaft
Schema einer Platin und Wasserstoffzelle: 1. 2 Platinelektrode. Wasserstoffgas 3. Säurelösung 4. Hidroseal 5. Einzahlung der Gewerkschaft Stellen Sie sich eine Zelle vor, die gasförmigen Wasserstoff verbraucht, Metallsilber produziert und gleichzeitig Strom benötigt. Dies ist die Platin- und Wasserstoffzelle, und ihre allgemeine Reaktion lautet wie folgt:
2AGCL (s) + h2(g) → 2AG (s) + 2h+ + 2cl-
Hier im Anodenfach haben wir eine inerte Platinelektrode, die in Wasser eingetaucht ist und in den Gaswasserstoff gepumpt wird. Die h2 zu h oxidieren+ und liefert seine Elektronen dem milchigen Niederschlag von Agcl im Kathodenfach mit einer Metallsilberelektrode. AGCL wird bei diesem Silber reduziert und der Elektrodenteig wird zunehmen.
Diese Zelle kann als:
Pt, h2 | H+ | | Cl-, Agcl | Ag
Downs Cell
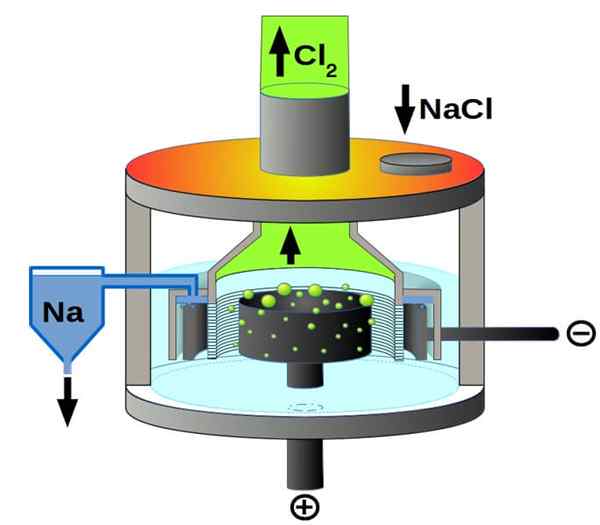 Downs -Zellschema für die Natriumchloridelektrolyse. Quelle: Pchemiker, CC BY-SA 4.0, über Wikimedia Commons
Downs -Zellschema für die Natriumchloridelektrolyse. Quelle: Pchemiker, CC BY-SA 4.0, über Wikimedia Commons Und schließlich haben wir unter den Elektrolytzellen das geschmolzene Natriumchlorid, besser bekannt als Downs -Zelle. Hier wird Elektrizität dazu gebracht, durch die Elektroden ein Volumen geschmolzener NaCl durch die Elektroden zu reisen, und stammt so aus den folgenden Reaktionen:
2+(l) + 2e- → 2na (s) (Kathode)
2cl-(L) → Cl2(g) + 2e- (Anode)
2nacl (l) → 2na (s) + cl2(g) (globale Reaktion)
Dank Elektrizität und Natriumchlorid können metallische Natrium- und Chlorgas hergestellt werden.

