Ketogenese Arten von Körpern, Synthese und Abbau
- 1234
- 171
- Luca Holdt
Der Ketogenese Es ist der Prozess, durch das Acetoacetat, β-Hydroxybutirat und Aceton erhalten werden, die zusammen Ketonkörper werden. Dieser komplexe und fein regulierte Mechanismus wird in Mitochondrien aus dem Katabolismus von Fettsäuren durchgeführt.
Das Erhalten der Ketonkörper findet statt, wenn der Körper erschöpfenden Fastenzeiten ausgesetzt ist. Obwohl diese Metaboliten hauptsächlich in Leberzellen synthetisiert werden, werden sie als wichtige Energiequelle in unterschiedlichen Geweben wie Skelettmuskeln sowie in Herz- und Hirngewebe gefunden.
 Quelle: SAV VAS [CC0]
Quelle: SAV VAS [CC0] Β-Hydroxibutirat und Acetoacetat sind Metaboliten, die als Substrate in Herzmuskel und Nierenrinde verwendet werden. Im Gehirn werden Ketonkörper zu wichtigen Energiequellen, wenn der Körper seine Glukosereserve erschöpft hat.
[TOC]
Allgemeine Charakteristiken
Die Ketogenese wird als sehr wichtige physiologische oder metabolische Route angesehen. Im Allgemeinen wird dieser Mechanismus in der Leber durchgeführt, obwohl er gezeigt wurde, dass er in anderen Geweben durchgeführt werden kann, die Fettsäuren metabolisieren können.
Die Bildung von Ketonkörpern ist die Hauptstoffwechselableitung von Acetyl-CoA. Dieser Metaboliten wird aus dem Stoffwechselweg erhalten, der als β-Oxidation bekannt ist, was der Abbau von Fettsäuren ist.
Die Verfügbarkeit von Glukose in den Geweben, in denen eine β-Oxidation auftritt. In bestimmten Situationen sind oxidierte Fettsäuren fast ausschließlich auf die Synthese von Ketonkörpern gerichtet.
Typen und Eigenschaften von Ketonkörpern
Der ketonische Hauptkörper ist Acetoacetat oder Acetoessigsäure, das hauptsächlich in Leberzellen synthetisiert wird. Aus Acetoacetat werden die anderen Moleküle aus den Ketonkörpern abgeleitet.
Die Reduktion von Acetoessigsäure führt zu D-β-Hydroxybutirat, dem zweiten ketonischen Körper. Aceton ist eine schwierige Verbindung zum Abbau und wird durch eine spontane Decarboxylierungsreaktion von Acetoacetat erzeugt (daher erfordert es keine Intervention eines Enzyms), wenn es in hohen Blutkonzentrationen vorhanden ist.
Die Konfession von Ketonkörpern wurde durch Konvention angeordnet, da β-Hydroxybutirat streng genommen keine Ketonfunktion hat. Diese drei Moleküle sind in Wasser löslich, was ihren Bluttransport erleichtert. Seine Hauptfunktion besteht darin, bestimmte Gewebe als Skelett- und Herzmuskel Energie zu liefern.
Die an der Bildung von Ketonkörpern beteiligten Enzyme sind hauptsächlich in Leber und Nieren, was erklärt, dass diese beiden Standorte die Hauptproduzenten dieser Metaboliten sind. Seine Synthese tritt nur und ausschließlich in der mitochondrialen Matrix von Zellen auf.
Es kann Ihnen dienen: Sporulation: in Pflanzen, in Pilzen und in BakterienSobald diese Moleküle synthetisiert wurden, gehen sie in den Blutkreislauf, der sich mit den Geweben befasst.
Synthese von Ketonkörpern
Bedingungen für die Ketogenese
Das Stoffwechselziel von Acetyl-CoA aus β-Oxidation hängt vom Stoffwechselbedarf des Organismus ab. Dies wird auf co oxidiert2 und h2Oder über den Zitronensäurzyklus oder die Synthese von Fettsäuren, wenn der Metabolismus von Lipiden und Kohlenhydraten im Körper stabil ist.
Wenn der Körper Kohlenhydrate benötigt, wird Oxalacetat für die Glukoseherstellung (Gluconeogenese) verwendet, anstatt den Zitronensäurzyklus zu beginnen. Dies geschieht, wie bereits erwähnt, wenn der Körper eine gewisse Unfähigkeit hat, Glukose zu erhalten, in Fällen wie längerem Fasten oder dem Vorhandensein von Diabetes.
Aus diesem Grund wird die Acetyl-CoA, die aus der Oxidation von Fettsäuren resultiert, für die Produktion von Ketonkörpern verwendet.
Mechanismus
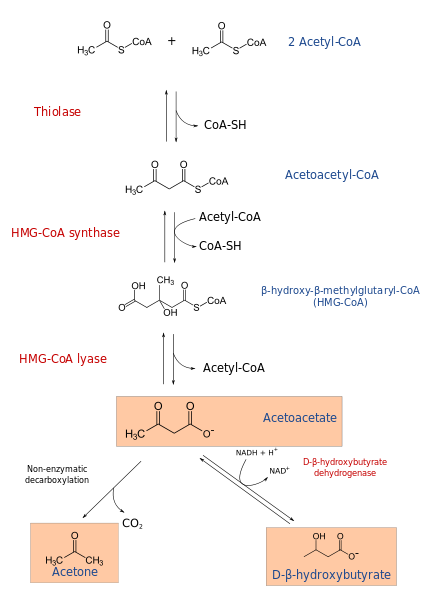
Der Ketogeneseprozess beginnt aus den Produkten der β-Oxidation: Acetacetyl-CoA oder Acetyl-CoA. Wenn das Substrat Acetyl-CoA ist, besteht der erste Schritt aus der Kondensation von zwei Molekülen, der Acetyl-CoA-Transferase-Reaktion, um Acetacetyl-CoA zu produzieren.
Die Acetacetyl-CoA wird durch die Wirkung der HMG-CoA-Synthase mit einer dritten Acetyl-CoA kondensiert, um HMG-CoA (β-Hydroxy-β-Methylglutaril-CoA) zu produzieren). Die HMG-CoA wird von HMG-CoA LIASA-Aktion auf Acetoacetat und Acetyl-CoA abgebaut. Auf diese Weise wird der erste ketonische Körper erhalten.
Acetoacetat wird durch die Intervention der Dehydrogenase von β-Hydroxybutirat auf β-Hydroxybutirat reduziert. Diese Reaktion hängt von NADH ab.
Der ketonische Acetoacetatkörper ist eine β-Cethoacid, die eine nicht enzymatische Decarboxylierung erfährt. Dieser Prozess ist einfach und erzeugt Aceton und Co2.
Diese Reihe von Reaktionen führt somit zu Ketonkörpern. Diese, die in Wasser löslich sind.
Β-Oxidation und Ketogenese sind verwandt
Der Fettsäuremetabolismus erzeugt Substrate für die Ketogenese, sodass diese beiden Möglichkeiten funktional zusammenhängen.
Acetoacethyl-CoA ist ein Inhibitor des Metabolismus von Fettsäuren, da sie die Aktivität der Acyl-CoA-Dehydrogenase stoppt, die das erste Enzym der β-Oxidation ist. Darüber hinaus übt es auch die Hemmung der Acetyl-CoA-Transfer und der HMG-CoA-Synthase aus.
Das HMG-CoA-Synthase-Enzym, das dem CPT-I (Enzym an der Produktion von Acylkarnitin in β-Oxidation beteiligt ist), ist eine wichtige regulatorische Rolle bei der Bildung von Fettsäuren.
Es kann Ihnen dienen: Flora und Fauna von Zacatecas: repräsentativere ArtenRegulation der β-Oxidation und ihrer Wirkung auf die Ketogenese
Die Fütterung des Organismus reguliert eine komplexe Reihe hormoneller Signale. Kohlenhydrate, Aminosäuren und Lipide, die in der Ernährung konsumiert werden, werden in Form von Triacylglycerinolen im Fettgewebe abgelagert. Insulin, ein anabolisches Hormon, interveniert in die Synthese von Lipiden und die Bildung von Triacylglycerinolen.
Auf der mitochondrialen Ebene wird die β-Oxidation durch den Eintritt und die Teilnahme einiger Substrate in den Mitochondrien kontrolliert. Das Enzym CPT I synthetisiert Carnitin -Acyl aus Acil Cytosolic Acil.
Wenn der Körper gefüttert wird, erhöht Acetyl-CoA-Carboxylase und Citrat die CPT I-Spiegel, während die Phosphorylierung (cyclische AMP-abhängige Reaktion) verringert wird, während die Phosphorylierung verringert wird.
Dies führt zu einer Akkumulation von Malonil COA, die die Synthese von Fettsäuren stimuliert und seine Oxidation blockiert, wodurch ein vergeblicher Zyklus erzeugt wird.
Im Fasten ist die Aktivität von Carboxylase sehr niedrig, da die Spiegel des Enzyms CPT I reduziert wurden und auch phosphoryliert sind, die die Oxidation von Lipiden aktiviert und fördert, was anschließend die Bildung der Ketonkörper durch Acetyl ermöglicht -Coa.
Degradierung
Die Ketonkörper verbreiten sich außerhalb der Zellen, in denen sie synthetisiert wurden, und werden vom Blutkreislauf zum peripheren Gewebe transportiert. In diesen Geweben können sie durch den Zyklus von Tricarbonsäuren oxidiert werden.
In peripheren Geweben β-Hydroxybutirat wird zu Acetoacetat oxidiert. Anschließend wird das vorliegende Acetoacetat durch die Wirkung des 3-ZOA-Transferase-Enzyms aktiviert.
Succinil-CoA fungiert als Coa-Spender, der Succinat wird. Die Aktivierung von Acetoacetat tritt auf, um Succinyl-CoA zu verhindern.
Der resultierende Aceoacetyl-CoA leidet unter einem thiolithischen Bruch, der zwei Acetyl-CoA-Moleküle produziert.
Leberzellen fehlen die 3-Cotoacil-CoA-Transfer, wodurch verhindert wird. Auf diese Weise ist garantiert, dass die Ketonkörper in den Zellen, in denen sie produziert wurden.
Medizinische Relevanz von Ketonkörpern
Im menschlichen Körper können hohe Konzentrationen von Ketonkörpern im Blut zu besonderen Erkrankungen führen, die als Azidose und Ketonämie bezeichnet werden.
Kann Ihnen dienen: Sphingomyeline: Was ist, Struktur, Funktionen, SyntheseDie Herstellung dieser Metaboliten entspricht dem Katabolismus von Fettsäuren und Kohlenhydraten. Eine der häufigsten Ursachen für einen Zustand der pathologischen Ketogenese ist die hohe Konzentration an Essigsäure -Dicarbonated -Fragmenten, die sich nicht auf den Oxidationsweg von Tricarbonsäuren abbauen.
Infolgedessen steigt die Blutketonkörper über 2 bis 4 mg/100 n und ihre Anwesenheit im Urin. Dies führt zur Störung des Vermittlerstoffwechsels dieser Metaboliten.
Bestimmte Defekte in den hypophysen neuroglandulären Faktoren, die den Abbau und die Synthese der Ketonkörper zusammen mit Erkrankungen des Kohlenwasserstoffstoffwechsels regulieren, sind die Ursache für den Zustand der Hyperketonämie.
Diabetes mellitus und Akkumulation von ketonischen Körpern
Diabetes mellitus (Typ 1) ist eine endokrine Erkrankung, die zu einer Zunahme der Produktion von Ketonkörpern führt. Insulin unzureichende Produktionsstörungen diskutieren Glukose für die Muskeln, die Leber und das Fettgewebe, wodurch sich im Blut ansammelt.
Zellen in Abwesenheit von Glucose beginnen den Prozess der Glukoneogenese und Abbau von Fett und Proteinen, um ihren Stoffwechsel wiederherzustellen. Infolgedessen verringern und erhöhen Oxalacetatkonzentrationen und erhöhen die Oxidation von Lipiden.
Es tritt eine Acetyl-CoA.
Die Akkumulation von Aceton wird durch seine Anwesenheit im Urin und im Atem von Menschen festgestellt.
Verweise
- Blázquez Ortiz, C. (2004). Ketogenese in Astrozyten: Charakterisierung, Regulation und mögliches zytoprotektives Papier (Dissertation Doktorand, Kompletense University of Madrid, Publications Service).
- Devlin, t. M. (1992). Lehrbuch der Biochemie: mit klinischen Korrelationen.
- Garrett, r. H., & Grisham, C. M. (2008). Biochemie. Thomson Brooks/Cole.
- McGry, j. D., Mannaerts, g. P., & Foster, D. W. (1977). Eine mögliche Rolle für Malonyl-CoA bei der Regulation der Oxidation und Ketogenese der Leberfettsäure und der Leberfettsäure. Das Journal of Clinical Investigation, 60(1), 265-270.
- Melo, v., Ruiz, v. M., & Cuamatzi, oder. (2007). Biochemie von Stoffwechselprozessen. Reverte.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Pertierra, a. G., Gutiérrez, c. V., & Andere, c. M. (2000). Grundlagen der metabolischen Biochemie. LETERIONISCHE TéBAR.
- Voet, d., & Voet, j. G. (2006). Biochemie. Ed. Pan -American Medical.
- « Kontinentales Frühstück Was ist und welche Lebensmittel es beinhaltet?
- Calciumperoxid (CAO2) Eigenschaften, Risiken und Verwendung »

