Kaliumcyanid (KCN) Eigenschaften, Verwendungen, Strukturen, Risiken,

- 4314
- 589
- Nick Laurén
Er Kaliumcyanid Es ist eine anorganische Verbindung, die von einem Ion Kalium k gebildet wird+ und ein CN -Cyanid -Ion-. Seine chemische Formel ist KCN. Es ist ein kristalliner weißer Feststoff, extrem giftig.
Das KCN ist im Wasser sehr löslich und beim Auflösen hydrolysiert es Cyanhydsäure oder HCN -Wasserstoff -Cyanid, was ebenfalls sehr giftig ist. Kaliumcyanid kann zusammengesetzte Salze mit Gold und Silber bilden, sodass es verwendet wurde, um diese Edelmetalle aus bestimmten Mineralien zu extrahieren.
 Solid KCN -Kaliumcyanid. Morienus (hochgeladen von DE: Benzutzer: Bxxxd von: Wiki) [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons.
Solid KCN -Kaliumcyanid. Morienus (hochgeladen von DE: Benzutzer: Bxxxd von: Wiki) [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons. Das KCN wird verwendet, um billige Metalle mit Gold und Silber durch einen elektrochemischen Verfahren abzudecken, dh eine Methode, bei der ein elektrischer Strom durch eine Lösung geleitet wird, die ein Salz aus Edelmetall, Cyanid und Kalium enthält.
Kaliumcyanid, weil es Cyanid enthält. Es sollte niemals in die Umwelt verworfen werden, da es auch für die meisten Tiere und Pflanzen sehr giftig ist.
Methoden, die gemeinsame Algen verwenden.
[TOC]
Struktur
KCN ist eine ionische Verbindung, die durch ein Kaliumkation K gebildet wird+ und ein Cyanidanion CN-. Darin ist das Kohlenstoffatom durch eine dreifache kovalente Bindung mit dem Stickstoffatom verbunden.
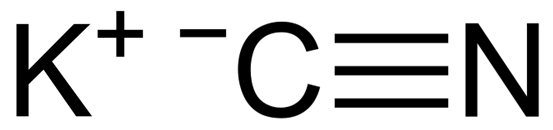 KCN -Kaliumcyanid -chemische Struktur. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
KCN -Kaliumcyanid -chemische Struktur. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. In festem Kaliumcyanid ist der CN -Anion- Es kann sich frei danach drehen, was sich wie ein kugelförmiger Anion verhält, als Folge des KCN -Kristall.
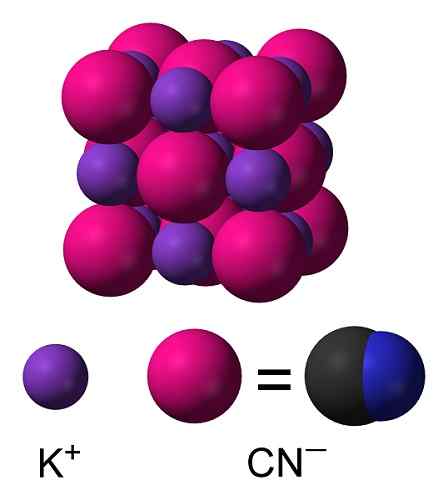 KCN -Kristallstruktur. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
KCN -Kristallstruktur. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
- Kaliumcyanid
- Kaliumcyanid
- Cianopotasio
Eigenschaften
Körperlicher Status
Weißer kristalline Feststoff. Kubikkristalle.
Molekulargewicht
65.116 g/mol.
Schmelzpunkt
634,5 ° C
Es kann Ihnen dienen: Aluminiumsulfat (Al2 (SO4) 3)Siedepunkt
1625 ° C.
Dichte
1,55 g/cm3 bei 20 ° C.
Löslichkeit
Sehr löslich in Wasser: 716 g/l bei 25 ° C und 100 g/100 ml Wasser bei 80 ° C. Wenig löslich in Methanol: 4,91 g/100 g Methanol bei 19,5 ° C. Sehr wenig löslich in Ethanol: 0,57 g/100 g Ethanol bei 19,5 ° C.
pH
Eine wässrige Lösung von 6,5 g KCN in 1 l Wasser hat einen pH -Wert von 11,0.
Hydrolysekonstante
KCN ist im Wasser sehr löslich. Wenn das Cyanid -Ion CN frei ist- das braucht einen Proton H+ von Wasser zur Bildung von HCN Cyanhydsäure und der Freigabe eines OH -Ions-:
CN- + H2O → HCN + OH-
Die Hydrolysekonstante zeigt den Trend an, mit dem diese Reaktion durchgeführt wird.
KH = 2,54 x 10-5
KCN wässrige Lösungen füllen die HCN -Wasserstoff -Cyanid -Umgebung frei, wenn sie 80 ° C erhitzen.
Chemische Eigenschaften
Es ist nicht brennbar, aber wenn der feste KCN erhitzt wird, bis seine Zersetzung sehr giftiges HCN -Wasserstoff -Cyanid ausstrahlt, tut es Stickoxide nichtX, K -Potiumoxid2O- und Kohlenmonoxid.
Die KCN reagiert mit Goldsalzen, die Kalium Aurocianuro Kau (CN) bilden2 und Kalium Auricianuro Kau (CN)4. Dies sind Komplexe farblose Salze. Mit der Silbermetall -Ag bildet das KCN das Kaliumargentocyanid Kag (CN)2.
Das KCN -Cyanid -Ion reagiert mit bestimmten organischen Verbindungen mit Halogen (wie Chlor oder Brom) und nimmt den Ort dieser ein. Zum Beispiel reagiert es mit Bromessigsäure, um Cyanoessigsäure zu ergeben.
Andere Eigenschaften
Es ist hygroskopisch, absorbiert Feuchtigkeit der Umwelt.
Es hat einen sanften Geruch von bitteren Mandeln, aber dies wird von allen Menschen nicht erkannt.
Erhalten
Das KCN wird durch die Koh -Kaliumhydroxid -Reaktion in wässriger Lösung mit HCN -Wasserstoff -Cyanid hergestellt. Das Kaliumferrocyanid K wird ebenfalls durch Erhitzen erhalten4Glaube (CN)6:
K4Glaube (CN)6 → 4 kcn + 2 c + n2↑ + Glaube
Verwendung in Metallelektrode
Es wird im Prozess der Abdeckung kleiner wertvoller Metalle mit Gold und Silber verwendet. Es ist ein elektrolytischer Prozess, dh Elektrizität wird durch eine wässrige Lösung mit geeigneten Salzen geleitet.
Es kann Ihnen dienen: Schwefeltrioxid (SO3): Struktur, Eigenschaften, Risiken, verwendetSilber
Kaliumargentocyanid Kag (CN) wird verwendet2 Zur Beschichtung mit billigeren Metallen (AG).
Diese werden in eine wässrige Lösung von Kaliumkag (CN) platziert2, Wo die positive Anode oder der Pole eine reine Silberstange (AG) und die Kathode oder der negative Pol das billige Metall sind, das Silber beschichten wollte.
Wenn ein elektrischer Strom durch die Lösung führt, wird das Silber auf dem anderen Metall abgelagert. Wenn Cyanidsalze verwendet werden.
 Einige Schmuckstücke sind mit Silber mit KCN -Salzen bedeckt. Autor: StockSnap. Quelle: Pixabay.
Einige Schmuckstücke sind mit Silber mit KCN -Salzen bedeckt. Autor: StockSnap. Quelle: Pixabay. Gold
In ähnlicher Weise im Fall von Gold (AU) das Kalium -Aurocyanid Kau (CN)2 und Kalium Auricianuro Kau (CN)4 Andere Metalle werden an elektrolytisch braun verwendet.
 Elektrische Anschlüsse mit Gold, die möglicherweise mit KCN -Salzen mit Gold beschichtet sind. CJP24 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Elektrische Anschlüsse mit Gold, die möglicherweise mit KCN -Salzen mit Gold beschichtet sind. CJP24 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Andere Verwendungen
Einige andere Verwendungen von Kaliumcyanid werden unten erwähnt.
- Für den industriellen Prozess der Verhärtung von Nitrorationsstahl (Stickstoffzugang).
- Zur Metallreinigung.
- Bei Druck- und Fotografieprozessen.
- Früher wurde es für die Extraktion von Gold und Silber aus den Mineralien verwendet, die sie enthalten, aber es wurde dann durch das Natrium -NACN -Cyanid ersetzt, das weniger teuer ist, wenn auch gleichermaßen giftig.
- Als Insektizid für die Begasung von Bäumen, Schiffen, Eisenbahnautos und Lagern.
- Als Reagenz in der analytischen Chemie, dh chemische Analyse durchzuführen.
- Andere chemische Verbindungen wie Farbstoffen und Farbstoffe herzustellen.
 Goldgewinnung in Südafrika im Jahr 1903 mit KCN, was in der sterblichen Verschmutzung der Umgebung war. Argyll, John Douglas Sutherland Campbell, Herzog von, 1845-1914; Creswicke, Louis [Keine Einschränkungen]. Quelle: Wikimedia Commons.
Goldgewinnung in Südafrika im Jahr 1903 mit KCN, was in der sterblichen Verschmutzung der Umgebung war. Argyll, John Douglas Sutherland Campbell, Herzog von, 1845-1914; Creswicke, Louis [Keine Einschränkungen]. Quelle: Wikimedia Commons. Risiken
KCN ist eine sehr giftige Verbindung für Tiere und die meisten Pflanzen und Mikroorganismen. Wird als super giftig eingestuft. Es ist in sehr kleinen Mengen immer noch tödlich.
Es kann Ihnen dienen: Nickelchlorid (NICL2): Struktur, Eigenschaften, erhalten, verwendet, verwendetDie schädliche Wirkung kann durch Einatmen, Kontakt mit Haut oder Augen oder Einnahme auftreten. Hemmt viele Stoffwechselprozesse, insbesondere Blutproteine, die am Sauerstofftransport wie Hämoglobin beteiligt sind.
Es betrifft die Organe oder Systeme, die empfindlicher für den Mangel an Sauerstoff wie das Zentralnervensystem (Gehirn), das Herz -Kreislauf -System (Herz- und Blutgefäße) und Lungen sind.
 Kaliumcyanid ist ein Gift. Autor: Clker-Free-Vektor-Images. Quelle: Pixabay.
Kaliumcyanid ist ein Gift. Autor: Clker-Free-Vektor-Images. Quelle: Pixabay. Wirkmechanismus
KCN stört die Fähigkeit des Körpers, Sauerstoff zu verwenden.
Das Cyanid -Ion CN- des KCN hat eine große Affinität zum Eisenglauben Glaubens Glauben3+, Das bedeutet, dass Cyanid, wenn es absorbiert, schnell mit dem Glauben reagiert3+ Blut und Gewebe.
Auf diese Weise verhindert es die Atmung von Zellen, die in einen Sauerstoffmangel eintreten, denn obwohl sie versuchen zu atmen, können sie es nicht benutzen.
Es tritt dann ein vorübergehender Zustand der Hipperapnoe (Atemaufhängung) und Kopfschmerzen und schließlich durch den Tod durch Atemstände auf.
Zusätzliche Risiken
Beim Erhitzen erzeugt es sehr giftige Gase wie HCN, StickstoffoxideX, K -Potiumoxid2O- und Kohlenmonoxid.
Bei Kontakt mit HCN -Feuchtigkeit, der hoch entflammbar und sehr giftig ist.
KCN ist auch sehr giftig für Wasserorganismen. Es sollte niemals in die Umwelt verworfen werden, da Wasserverschmutzung auftreten kann, wenn sie Tiere trinken und Fische bewohnen.
Es gibt jedoch Bakterien, die Cyanid produzieren, z Chromobacterium Violaceum und einige Arten von Arten von Pseudomonas.
Aktuelle Studien
Bestimmte Forscher fanden heraus, dass die grünen Algen Chlorella vulgaris Es kann verwendet werden, um kontaminiertes Wasser mit KCN -Kaliumcyanid in niedrigen Konzentrationen zu behandeln.
Die Algen konnten das KCN effizient entfernen, da dies in niedrigen Größen das Wachstum der Algen stimulierte, da es einen inneren Mechanismus aktivierte, um der Toxizität der KCN zu widerstehen.
Dies bedeutet, dass die Algen Chlorella vulgaris Es hat das Potenzial, Cyanid zu entfernen und eine wirksame Methode zur biologischen Behandlung von Cyanid -Kontamination könnte damit ausgelegt werden.
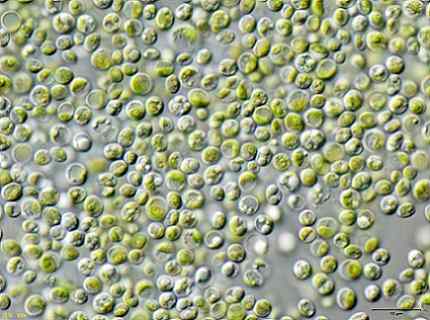 Algenbild Chlorella vulgaris in einem Mikroskop beobachtet. Ja: Benutzer: Neon / Benutzer: neon_ja [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Algenbild Chlorella vulgaris in einem Mikroskop beobachtet. Ja: Benutzer: Neon / Benutzer: neon_ja [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Kaliumcyanid. Nationales Zentrum für Biotechnologie Information. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Coppock, r.W. (2009). Bedrohungen für die Tierwelt durch chemische Kriegsmittelagenten. In Handbook of Toxicology of Chemical Warfare Agents. Von Scientedirect erholt.com.
- Liu, q. (2017). Bewertung der Entfernung von Kaliumcyanid und ihrer Toxizität in grünen Algen (Chlorella vulgaris). Bulle Environment Contam Toxicol. 2018; 100 (2): 228-233. NCBI erholte sich.NLM.NIH.Regierung.
- Das Nationale Institut für Arbeitssicherheit und Gesundheit (NIOSH). (2011). Kaliumcyanid: Systemischer Mittel. CDC wiederhergestellt.Regierung.
- Alvarado, l.J. et al. (2014). Riboswitch -Entdeckung, Struktur und Funktion. Synthese von Uracil. In Methoden in der Enzymologie. Von Scientedirect erholt.com.
- « Natriumtripoliphosphat (Na5p3O10) Struktur, Eigenschaften, Verwendungszwecke, Auswirkungen
- Weil ich sehr müde bin? 9 Ursachen und Lösungen »

