Natriumcyanid (NACN) Struktur, Eigenschaften, Risiken, verwendet

- 3846
- 1163
- Jasmine Kupprion
Er Natriumcyanid Es handelt+ und ein Cyanidanion CN-. Seine chemische Formel ist NACN. Auch als Natriumcyanid bekannt, ist es ein weißer kristalline Feststoff. Es ist hygroskopisch, dh es absorbiert Wasser aus der Umwelt und seine Kristalle sind kubisch wie das Natriumchlorid NaCl.
Beim Auflösen in Wasser neigt es dazu, HCN -Wasserstoffcyanid zu bilden. Seine Lösungen lösten Gold und Silber leicht auf. Mit dieser Funktion wird es verwendet, um Gold und Silber aus seinen Mineralien zu extrahieren. Die für diesen Zweck verwendeten Lösungen werden recycelt, dh sie werden mehrmals wiederverwendet.
 Natrium -Natrium -Natriumcyanid. L26 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Natrium -Natrium -Natriumcyanid. L26 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Einige Cyanid schafft es jedoch, bestimmten Abfallteichen zu entkommen, was eine Gefahr für Fauna und Mensch darstellt, da Cyanid sehr giftig ist und den Tod verursachen kann.
NACN wird in der chemischen Industrie als Vermittler verwendet, um verschiedene Arten von Verbindungen wie Farbstoffen, Chemikalien für Landwirtschaft und Arzneimittel oder Medikamente herzustellen.
Natriumcyanid ist eine sehr gefährliche Verbindung, weil es den Tod verursachen kann. Daher muss es mit äußerster Vorsicht manipuliert werden.
[TOC]
Struktur
Natriumcyanid wird durch ein Ionen Na+ und ein Ion CN gebildet-.
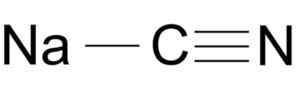 Natriumcyanidmolekülstruktur NACN. Pfeilmeister [Public Domain], Quelle: Wikimedia Commons.
Natriumcyanidmolekülstruktur NACN. Pfeilmeister [Public Domain], Quelle: Wikimedia Commons. Das Cyanid -Ion verfügt.
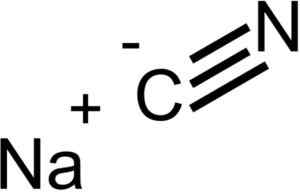 Ionen, aus denen Natriumcyanid NACN besteht. EPOP [Public Domain]. Quelle: Wikimedia Commons.
Ionen, aus denen Natriumcyanid NACN besteht. EPOP [Public Domain]. Quelle: Wikimedia Commons. NACN hat die gleiche kristalline Struktur wie NaCl, daher sind seine Kristalle kubisch.
Nomenklatur
-Natriumcyanid
-Natriumcyanid
Eigenschaften
Körperlicher Status
Hygroskopisch weißer kristalline Feststoff (Wasser aus der Umwelt absorbieren).
Molekulargewicht
49.007 g/mol
Schmelzpunkt
563,7 ºC
Siedepunkt
1496 ºC
Flammpunkt
Es ist nicht brennbar. Wenn es jedoch einem Feuer ausgesetzt ist, treten HCN -Wasserstoff -Cyanid und Stickoxide auf.
Kann Ihnen dienen: Sublimation: Konzept, Prozess und BeispieleDichte
1,595 g/cm3 bei 20 ºC
Löslichkeit
Sehr löslich in Wasser: 48 g/100 ml bei 10 ° C, 82 g/100 ml bei 35 ° C. Etwas löslich in Alkohol
Dissoziationskonstante
Es ist in wässriger Lösung hydrolysiert, die HCN -Wasserstoffcyanid erzeugt. Die Konstante dieser Hydrolyse ist kH = 2,5 x 10-5.
pH
Wässrige NACN -Lösungen sind stark alkalisch
Chemische Eigenschaften
Beim Auflösen in Wasser trennt es seine Na -Ionen+ und cn-. In wässriger Lösung das Cyanid -Ion CN- Nehmen Sie einen Proton H+ von Wasser h2Oder HCN und ein OH -Ion bilden-, Die Lösung wird also alkalisch.
CN- + H2O → HCN + OH-
Aus diesem Grund zersetzen sich ihre wässrigen Lösungen schnell, indem sie gespeichert bleiben und HCN -Wasserstoffcyanid bilden.
Es ist ätzend gegenüber Aluminium. Seine Lösungen lösten die AU und die Silber AG in Gegenwart von Luft leicht auf.
Es ist ein Chelatmittel, weil der Cyanidanion CN- Es kann leicht anderen Metallen wie Silber, Gold, Quecksilber, Zink, Cadmium usw. beitreten.
Präsentiert einen schwachen Geruch von bitteren Mandeln.
Risiken
Muss sehr sorgfältig behandelt werden. Es handelt sich um eine sehr giftige Verbindung, hemmt wichtige Stoffwechselprozesse und führt sowohl zur Aufnahme, Inhalation, Hautabsorption oder Augenkontakt zum Tod.
Wenn das NACN eingeatmet wird, löst es sich in der Schleimhaut des Atemwegs auf und übergeht zum Blutkreislauf. Das Cyanid -Ion von NACN hat eine starke Affinität zu Eisen in einem Oxidationszustand von +3, dh dem Eisenkations -Glauben3+.
Wenn Cyanid absorbiert wird, reagiert es schnell mit dem Glauben3+ eines wichtigen Enzyms der Mitochondrien der Zellen (Oxidase -Cytochrom), wodurch bestimmte Atemprozesse durchgeführt werden.
Daher wird die Zellatmung inhibiert oder bremst und ist eine zytotoxische Hypoxie. Dies bedeutet, dass Zellen und Gewebe nicht in der Lage sind, Sauerstoff zu verwenden, insbesondere Hirn- und Herzzellen.
Auf diese Weise treten dauerhafte oder tödliche Schäden am Körper auf. Dies kann sowohl beim Menschen als auch beim Tieren passieren.
Wenn die Überlastung von Blutgefäßen und Korrosion der Magenschleimhaut zusätzlich zu den bereits erwähnten Einstiegungen aufnimmt.
Kann Ihnen dienen: Justus von Liebig Natriumcyanid NACN kann zum Tod führen. Autor: Openicons. Quelle: Pixabay.
Natriumcyanid NACN kann zum Tod führen. Autor: Openicons. Quelle: Pixabay. Es ist kein Brennstoff, sondern in Kontakt mit Säuren, es setzt HCN frei, das hoch entflammbar und giftig ist.
Wenn es mit Nitriten oder Chloraten schmilzt, kann es nutzen.
Erhalten
Es kann mit Natrium na, Ammoniak NH erhalten werden3 und Kohle c. Das Natrium reagiert mit dem Ammoniak, das Natriumnanh enthält2:
2 Na + 2 NH3 → 2 Nanh2 + H2↑
Natriumamid ist bei 600 ° C mit Kohlenstoff erhitzt und erzeugt Natriumcyanamid na2NCN, das dann mit Kohle bei 800 ° C Natriumcyanid wird:
2 Nanh2 + C → 2 h2↑ + na2NCN
N / A2NCN + C → 2 NACN
Eine andere Methode besteht darin, Calcium und Kohlecyanamid C mit Natriumcarbonat NA zu schmelzen2CO3:
Cancn + C + Na2CO3 → Caco3 + 2 NACN
Es kann auch hergestellt werden, indem Stickstoffgas n bestanden wird2 für eine heiße Mischung aus Natriumcarbonat2CO3 und Kohle -C -Pulver und Verwendung des Glaubens als Katalysator oder Beschleuniger der Reaktion:
N / A2CO3 + 4 c + n2 → 2 NACN + 3 Co ↑
Anwendungen
Bei der Extraktion von Gold- und Silbermineralien. Folgen
Natriumcyanid wurde seit langem verwendet, um Gold- und Silbermetalle aus seinen Mineralien zu extrahieren.
Das im Prozess verwendete Cyanid wird recycelt, aber etwas entgeht dem Abfallteich zusammen mit den nicht geborgenen Schwermetallen.
Vögel, Fledermäuse und andere Tiere, die mit Cyanid aus diesen Lagunen trinken, wurden vergiftet.
Es gibt Aufzeichnungen über einen Rumänien -Damm, der einen Abfallteich isoliert hat und durch ein Wetterereignis beschädigt wurde.
Infolgedessen wurden Tonnen von Cyanid in den Sasar River und in den nahe gelegenen Grundwasserleitungssystemen wie Lapus, Somes, Tisza Rivers freigelassen, die in der Donau enden.
Dies verursachte einen Wasserfall von tierischen Todesfällen oder mit anderen Worten eine ökologische Katastrophe.
 Goldextraktion mit Cyanid in Neuseeland um 1918 um 1918. Sie können die Menge an kontaminiertem Wasser sehen, das in den nahe gelegenen Flüssen entlassen wurde. Nationalbibliothek NZ auf den Commons [keine Einschränkungen]. Quelle: Wikimedia Commons.
Goldextraktion mit Cyanid in Neuseeland um 1918 um 1918. Sie können die Menge an kontaminiertem Wasser sehen, das in den nahe gelegenen Flüssen entlassen wurde. Nationalbibliothek NZ auf den Commons [keine Einschränkungen]. Quelle: Wikimedia Commons. In der Produktion anderer chemischer Verbindungen
Natriumcyanid NACN wird zur Synthese verschiedener Arten von organischen Verbindungen verwendet.
Kann Ihnen dienen: Natriumoxid (Na2o): Struktur, Formel, Eigenschaften, RisikenZum Beispiel werden Pigmente und Farbstoffe hergestellt (einschließlich optischer Polituren), Verbindungen zur Verwendung in Landwirtschaft oder Agrochemikalien und verschiedenen pharmazeutischen Produkten.
Es dient auch dazu, Chelat- oder Entführungsmittel von Metallionen zu erhalten.
Mit Natriumcyanid werden die als Nitrile bezeichneten Verbindungen hergestellt, die, wenn sie mit Säuresäure oder alkalischer wässriger Lösung behandelt werden, Carbonsäuren erhalten können.
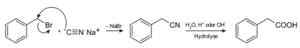 Herstellung einer Carbonsäure unter Verwendung von Natriumcyanid NACN. Roland Matter [Public Domain]. Quelle: Wikimedia Commons.
Herstellung einer Carbonsäure unter Verwendung von Natriumcyanid NACN. Roland Matter [Public Domain]. Quelle: Wikimedia Commons. Es ermöglicht Fettsäuren mit Cyanogruppen, Schwermetallcyaniden und Wasserstoffcyanid HCN.
In der Metallindustrie
NACN wird in den Lösungen verwendet.
Es ist ein Bestandteil des gehärteten Stahls. Es dient auch bei der Reinigung von Metallen.
In anderen Verwendungen
Natriumcyanid ist ein Vermittler bei der Herstellung von Nylon.
Es wird verwendet, um Mineralien durch Flotation mit Schaum zu trennen.
Anwendungen aus dem Gebrauch, in Frage oder sehr selten
Die Nation wurde verwendet, um Nagetiere wie Kaninchen und Ratten und ihre Höhlen zu beseitigen und Termitennester zu beenden.
Es wird derzeit gelegentlich verwendet, um Kojoten, Füchse und wilde Hunde zu beseitigen. Es wird in Form von Kapseln als einfache oder mehrere Dosen in Weidelanden, Jagd und Wäldern verwendet.
Aufgrund seiner extremen Toxizität muss NACN nur von vorbereiteten Menschen verwendet werden.
Diese Verwendung gilt für den Menschen als sehr gefährlich, aber es gibt diejenigen, die sie immer noch benutzen.
 Wildes Leben sollte nicht beseitigt werden, da diese Tiere bereits gegen das Überleben unter schwierigen Bedingungen kämpfen. Autor: Maxwdhs. Quelle: Pixabay.
Wildes Leben sollte nicht beseitigt werden, da diese Tiere bereits gegen das Überleben unter schwierigen Bedingungen kämpfen. Autor: Maxwdhs. Quelle: Pixabay. In der Landwirtschaft wurde es zuvor verwendet, um Zitrusfruchtbäume und andere Früchte zu räumen. Es wurde auch als Insektizid und Mitizid (Milbe -Eliminator) verwendet. Es wurde auch verwendet, um Schiffe, Eisenbahnwagen und Lagerhäuser zu rösten.
Alle diese Verwendungen wurden durch die hohe Toxizität von Natriumcyanid in Frage gestellt. Aus diesem Grund wird es nicht mehr verwendet oder nur sehr selten und unter sehr kontrollierten Bedingungen.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Natriumcyanid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Söhne.
- Hurst, h.UND. und Martin, m.D. (2017). Toxikologie. Zyanid. In Pharmakologie und Therapeutik für Zahnmedizin (siebte Ausgabe). Von Scientedirect erholt.com.
- Coppock, r.W. und dziwenka, m. (2015). Bedrohungen für die Tierwelt durch chemische Kriegsmittelagenten. In Handbook of Toxicology of Chemical Warfare Agents (zweite Ausgabe). Von Scientedirect erholt.com.
- Morrison, r.T. und Boyd, r.N. (2002). Organische Chemie. 6. Ausgabe. Prentice-Hall.
- « Schwefeltrioxid (SO3) Struktur, Eigenschaften, Risiken, verwendet
- Bariumoxid (BAO) Struktur, Eigenschaften, Verwendung, Risiken »

