Carnot -Zyklusstadien, Anwendungen, Beispiele, Übungen
- 1529
- 243
- Rieke Scheer
Er Carnot -Zyklus Es ist die Abfolge thermodynamischer Prozesse, die in einem Carnot -Engine stattfinden, einem idealen Gerät, das nur reversible Prozesse besteht. Das heißt, diejenigen, die, nachdem sie stattgefunden hatten, in den Anfangszustand zurückkehren können.
Diese Art von Motor wird als ideal angesehen, da ihm die Ableitung, Reibung oder Viskosität in realen Maschinen fehlt und die thermische Energie in nutzbare Arbeiten verwandelt, obwohl die Umwandlung nicht 100% durchgeführt wird.
 Abbildung 1. Eine Dampflokomotive. Quelle: Pixabay
Abbildung 1. Eine Dampflokomotive. Quelle: Pixabay Ein Motor basiert auf einer Substanz, die in der Lage ist, Arbeiten wie Gas, Benzin oder Dampf zu erledigen. Diese Substanz unterliegt verschiedenen Temperaturänderungen und erfährt wiederum Unterschiede in ihrem Druck und Volumen. Auf diese Weise ist es möglich, einen Kolben in einen Zylinder zu bewegen.
[TOC]
Was ist der Carnot -Zyklus?
Der Carnot -Zyklus findet in einem System namens Carnot oder C -Motor statt, das ein ideales Gas in einem Zylinder ist und mit einem Kolben versehen ist, der mit zwei Quellen bei verschiedenen Temperaturen in Kontakt steht1 und T2 wie die in der folgenden Abbildung links gezeigt.
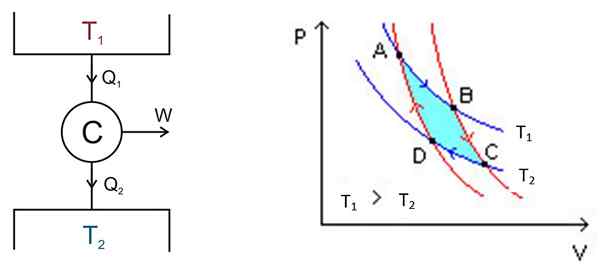 Figur 2. Links ein Schema der C -Arnot -Maschine rechts das PV -Diagramm. Quelle der linken Abbildung: Keta - eigene Arbeit, CC von 2.5, https: // Commons.Wikimedia.org/w/Index.Php?Curid = 681753, rechte Figur Wikimedia Commons.
Figur 2. Links ein Schema der C -Arnot -Maschine rechts das PV -Diagramm. Quelle der linken Abbildung: Keta - eigene Arbeit, CC von 2.5, https: // Commons.Wikimedia.org/w/Index.Php?Curid = 681753, rechte Figur Wikimedia Commons. Es gibt die folgenden Prozesse in einem groben Modus:
- Das Gerät wird eine bestimmte Wärmemenge geliefertEingang = Q1 Aus dem thermischen Tank bei hoher Temperatur t1.
- Der Carnot C -Motor führt dank dieser gelieferten Wärme eine Arbeit durch.
- Ein Teil der verwendeten Wärme: der Abfall QAusfahrt, Es wird in den thermischen Tank übertragen, der bei einer niedrigeren Temperatur t ist2.
Carnot -Zyklusstadien
Die Analyse wird durch ein P -V -Diagramm (Druck -Volumen) durchgeführt, wie in Abbildung 2 (rechte Abbildung) gezeigt. Das Ziel des Motors kann darin bestehen, die thermische Ablagerung 2 kalt zu halten und Wärme abzuziehen. In diesem Fall ist es a Kältemaschine. Wenn Sie im Gegenteil der thermischen Ablagerung Wärme geben möchten 1, dann ist es a Wärmepumpe.
Das P -V -Diagramm zeigt Druckänderungen - Motortemperatur unter zwei Bedingungen:
- Aufrechterhaltung der konstanten Temperatur (isothermaler Prozess).
- Keine Wärmeübertragung (Wärmeisolierung).
Die beiden isothermen Prozesse müssen angeschlossen werden, was mittels Wärmeisolierung erreicht wird.
Punkt
Sie können an jedem Punkt im Zyklus beginnen, in dem Gas einen bestimmten Druck, Volumen und Temperaturbedingungen aufweist. Das Gas erleidet eine Reihe von Prozessen und kann zu den Startbedingungen zurückkehren, um einen anderen Zyklus zu beginnen. Da Energie erhalten bleibt:
Arbeiten durch C = Eingangswärme - Abfahrtswärme
ΔW = qEingang - QAusfahrt
Der Bereich, der in diesem Zyklus oder in der Schleife in der Abbildung in türkiser Abbildung enthalten ist.
Die Punkte A, B, C und D sind in Abbildung 2 markiert. Es beginnt mit dem Punkt, dem blauen Pfeil zu folgen.
Erste Stufe: isotherme Expansion
Die Temperatur zwischen den Punkten A und B ist t1. Das System absorbiert Wärme aus der thermischen Ablagerung 1 und leidet an einer isothermen Ausdehnung. Dann nimmt das Volumen zu und der Druck nimmt ab.
Die Temperatur bleibt jedoch in t1, Da das Gas erweitert, kühlt es ab. Daher bleibt seine innere Energie konstant.
Es kann Ihnen dienen: Graff Van Generator: Partys, wie es funktioniert, AnwendungenZweite Stufe: Adiabatische Expansion
In Punkt B beginnt das System eine neue Expansion, in der das System keine Wärme gewinnt oder verliert. Dies wird erreicht, indem es in Kalorienisolierung wie zuvor angegeben eingesetzt wird. Daher handelt es sich um eine adiabatische Expansion, die nach dem roten Pfeil weiterhin auf C zeigt. Das Volumen nimmt zu und der Druck nimmt ab, bis er seinen niedrigsten Wert erreicht.
Dritte Stufe: isotherme Komprimierung
Beginnen Sie bei Punkt C und enden Sie in D. Die Isolierung wird entfernt und das System kommt mit thermischer Ablagerung 2 in Kontakt, deren Temperatur t2 Es ist weniger. Das System liefert Abwärme in den Wärmebehälter, der Druck steigt und das Volumen sinkt ab.
Vierte Stufe: Adiabatische Komprimierung
Das System kehrt bis zu Punkt D und kehrt auf die thermische Isolierung zurück, der Druck steigt und das Volumen nimmt ab, bis die ursprünglichen Bedingungen des Punktes A erreicht sind. Dann wird der Zyklus wieder wiederholt.
Carnots Satz
Carnots Theorem wurde zu Beginn des 19. Jahrhunderts zum ersten Mal vom französischen Physiker Sadi Carnot postuliert. Im Jahr 1824 veröffentlichte Carnot, der Teil der französischen Armee war? Carnot stellte dann Folgendes fest:
Kein thermischer Motor zwischen zwei thermischen Ablagerungen ist effizienter als der Carnot -Motor.
Die η -Ausbeute eines thermischen Motors erfolgt durch das Verhältnis zwischen der durchgeführten Arbeit und der absorbierten Wärme q:
Leistung = Arbeit erledigt/Wärme absorbiert
Auf diese Weise ist die Leistung eines thermischen Motors I: η = w/q. Während die Leistung eines Carnot R -Motors η '= w/q' beträgt, können sie bei beiden Motoren den gleichen Job ausführen.
Carnots Theorem stellt fest, dass η niemals größer ist als η '. Andernfalls fällt es in den Widerspruch zum zweiten Thermodynamik -Wert. Deshalb:
η < η''
Carnots Theoremdemonstration
Um zu zeigen, dass dies so ist, betrachten Sie den Carnot -Motor, der als Kühlschrankmaschine fungiert, der von einem I -Motor angetrieben wird. Dies ist möglich, da der Carnot -Motor nach reversiblen Prozessen funktioniert, wie am Anfang angegeben.
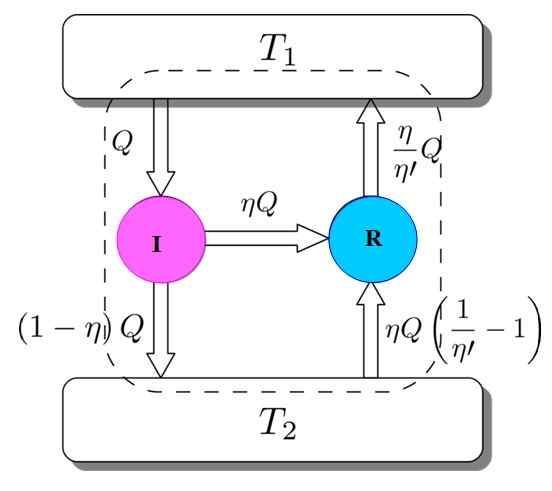
 Figur 3. Carnots Theoremdemonstration. Quelle: Netheril96 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Figur 3. Carnots Theoremdemonstration. Quelle: Netheril96 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Sie haben beide: Ich und R arbeiten mit denselben thermischen Ablagerungen und es wird angenommen, dass η > η''. Wenn unterwegs ein Widerspruch mit dem zweiten Gesetz der Thermodynamik erreicht wird, wird Carnots Theorem durch Reduktion der Absurdität demonstriert.
Abbildung 3 hilft, dem Prozess zu folgen. Der I -Motor nimmt eine Menge Wärme q, die auf diese Weise teilt: Arbeiten auf R entsprechen w = ηq und der Rest ist die übertragene Wärme (1 -η) q zum Wärmepanzer T T2.
Da die Energie erhalten bleibt, ist alles erfüllt:
UNDEingang = Q = Arbeit W + Wärme zugewiesen an t zugewiesen2 = ηq + (1 -η) q = eAusfahrt
Jetzt nimmt die Carnot R -Kühlschrankmaschine den Wärmebehälter 2 eine Wärmemenge, die gegeben wird:
Es kann Ihnen dienen: Nachahmung: Was besteht, Methode und Beispiele(η / η ') (1 -η') q =
Energie muss auch in diesem Fall aufbewahrt werden:
UNDEingang = ηq + (η / η ') (1 --η') q = (η / η ') q = q' = eAusfahrt
Das Ergebnis ist die Übertragung zum Wärmepanzer t2 einer Menge Wärme, die durch (η / η ') q = q' gegeben ist.
Wenn η größer als η ist, bedeutet dies, dass die höchste Temperatur thermische Ablagerung mehr Wärme erreicht ist, als ich ursprünglich genommen habe. Da kein externer Agent, wie beispielsweise eine andere thermische Quelle, teilgenommen hat, kann es nur dann passieren, dass die kälteste thermische Ablagerung die Hitze ergibt.
Dies ist mit dem zweiten Gesetz der Thermodynamik nicht einverstanden. Es wird dann abgeschlossen, dass es nicht möglich ist, dass η'' Seien Sie weniger als η, daher kann der I -Motor nicht mehr Leistung haben als die Carnot R -Maschine.
Theorem -Korollar und Einschränkungen
Die Carnot -Theorem -Korollar -Cororary gibt an, dass zwei Carnot -Maschinen die gleiche Effizienz haben, wenn beide mit denselben thermischen Ablagerungen betrieben werden.
Das bedeutet, dass die Substanz keine Rolle spielt, die Leistung ist unabhängig und kann nicht durch Ändern erhoben werden.
Die Schlussfolgerung der vorherigen Analyse ist, dass der Carnot -Zyklus die Spitze des ideal erreichbaren thermodynamischen Prozesss ist. In der Praxis gibt es viele Faktoren, die die Effizienz verringern, beispielsweise die Tatsache, dass die Isolation niemals perfekt ist, und in adiabatischen Stadien gibt es tatsächlich einen Kalorienaustausch mit außen.
Bei einem Auto ist der Motorblock beheizt. Andererseits verhalten sich das Gas- und Luftgemisch nicht genau wie ein ideales Gas, das der Ausgangspunkt des Carnot -Zyklus ist. Dies erwähnt nur einige Faktoren, die eine drastische Leistungsreduzierung verursachen.
Beispiele
Ein Kolben in einem Zylinder
Wenn das System wie in Abbildung 4 in einem Zylinder eingesperrt ist, steigt der Kolben während der isothermen Expansion auf.
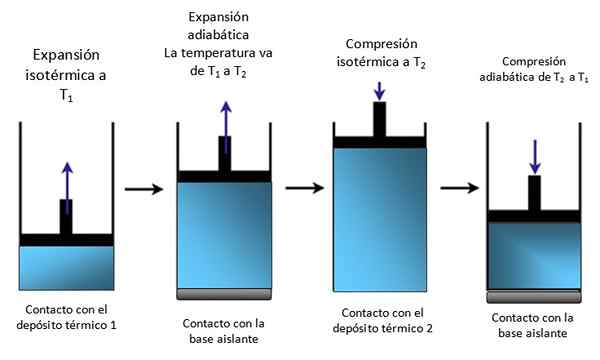 Figur 4. Bewegung eines Kolbens in einem Zylinder. Quelle: Selbst gemacht.
Figur 4. Bewegung eines Kolbens in einem Zylinder. Quelle: Selbst gemacht. Dann isotherm komprimiert, wärme und komprimiert weiter adiabatisch. Das Ergebnis ist eine Bewegung, bei der der Kolben in den Zylinder steigt und auf andere Teile eines bestimmten Geräts übertragen werden kann, z.
Verschiedene reversible Prozesse
Zusätzlich zur Ausdehnung und Komprimierung eines idealen Gases innerhalb eines Zylinders gibt es andere ideale reversible Prozesse, mit denen ein Carnot -Zyklus konfiguriert werden kann, beispielsweise:
- Hin- und Rückbewegungen in Abwesenheit von Reibung.
- Eine ideale Feder, die komprimiert und dekomprimiert ist und niemals deformiert.
- Elektrische Schaltungen, in denen es keinen Widerstand gibt, der Energie aufsetzt.
- Magnetisierungs- und Demagnetisierungszyklen, in denen es keine Verluste gibt.
- Laden und Herunterladen einer Batterie.
Ein Kernkraftwerk
Während es sich um ein sehr komplexes System handelt, ist ein erster Ansatz dessen, was erforderlich ist, um Energie im Kernreaktor zu produzieren, der folgende:
- Eine thermische Quelle, bestehend aus einem Material, das radioaktiv wie Uran zerfällt.
Kann Ihnen dienen: aktuelles Atommodell- Die Spüle oder die kalte thermische Ablagerung, die die Atmosphäre wäre.
- Die "Carnot -Maschine", die ein flüssiges, fast immer fließendes Wasser verwendet, das von der thermischen Quelle Wärme geliefert wird, um es in Dampf zu verwandeln.
Wenn der Zyklus durchgeführt wird, wird Strom als Nettoarbeit erhalten. Wenn Wasser in Hochtemperaturdampf umgewandelt wird, wird Wasser zu einer Turbine erreicht, wobei Energie in Bewegung oder kinetische Energie umgewandelt wird.
Die Turbine aktiviert wiederum einen elektrischen Generator, der die Energie seiner Bewegung in Strom umwandelt. Zusätzlich zu fieschendem Material wie Uran können fossile Brennstoffe natürlich als Wärmequelle verwendet werden.
Gelöste Übungen
-Beispiel 1: Effizienz einer thermischen Maschine
Die Effizienz einer thermischen Maschine ist definiert als das Verhältnis zwischen der Ausgangsarbeit und der Eingangsarbeit und ist daher eine dimensionslose Menge:
Maximale Effizienz = (qEingang - Q Ausfahrt) /QEingang
Maximale Effizienz als eMax, Es ist möglich, seine Temperaturabhängigkeit zu demonstrieren, was die einfachste Variable ist, die zu messen ist, wie beispielsweise:
UndMax = 1 - (t2/T1)
Wo t2 Es ist die Temperatur der Senken und t1 Es ist die thermische Quellentemperatur. Da letzteres größer ist, stellt sich die Effizienz immer als weniger als 1 heraus.
Nehmen wir an, dass eine thermische Maschine in der Lage ist, nach folgenden Arten zu arbeiten: a) zwischen 200 K und 400 K, b) zwischen 600 K und 400 K. Was ist jeweils die Effizienz??
Lösung
a) Im ersten Fall lautet die Effizienz:
UndMax1 = 1 - (200/400) = 0.fünfzig
b) Für den zweiten Modus wird der Effizienz sein:
UndMax2 = 1- (400/600) = 0.33
Obwohl die Temperaturdifferenz zwischen beiden Modi gleich ist, ist die Effizienz nicht. Und noch bemerkenswerter ist, dass der effizienteste Modus bei niedrigerer Temperatur arbeitet.
-Beispiel 2: Wärme absorbiert und Wärme abgeschoben
Eine thermische Maschine von 22 % produziert 1530 J Arbeit. Finden Sie: a) Die von der thermischen Ablagerung absorbierte Wärmemenge 1, b) die Wärmemenge, die dem Wärmebehälter 2 weggeworfen wurde.
a) In diesem Fall wird die Effizienzdefinition verwendet, da die Arbeiten nicht der Temperaturen der thermischen Ablagerungen verfügbar sind. 22% Effizienz bedeutet, dass e Max = 0.22, deshalb:
Maximale Effizienz = Arbeit /qEingang
Die Menge der absorbierten Wärme ist genau QEingang, Also räumen Sie: Sie haben:
QEingang = Arbeit/Effizienz = 1530 J/0.22 = 6954.5 J
b) Die Menge an Wärme, die dem kältesten Tank zugeordnet ist, stammt von ΔW = qEingang - QAusfahrt
QAusfahrt = QEingang - ΔW = 6954.5 -1530 J = 5424.5 J.
Ein anderer Weg ist von UndMax = 1 - (t2/T1). Da die Temperaturen nicht bekannt sind, aber diese mit Wärme zusammenhängen, kann der Effizienz auch als:
UndMax = 1 - (qVerrissen/Qabsorbiert)
Verweise
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 1. Mc Graw Hill. 654-657
- Kernenergie. Betrieb eines Kernkraftwerks. Erholt von: Energie-Nuklearer.Netz
- Serway, r., Jewett, J. (2008). Physik für Wissenschaft und Ingenieurwesen. Band 1. 7. Ed. Cengage Lernen. 618-622.
- Tippens, p. 2011. Physik: Konzepte und Anwendungen. 7. Ausgabe. MacGraw Hill. 414-416.
- Walker, J.2008. Physik. 4. Aufl.Addison Wesley. 610-630
- « Respekt in der Schule, wie man es und Konsequenzen anwendet
- Heizkurve Was ist, wie es tut, Beispiele »

