Cyclohexanstruktur, Verwendungen, Konformationen
- 1191
- 70
- Jasmine Kupprion
Er Cyclohexan Es ist ein relativ stabiler Zyklus mit der molekularen Formel C6H12. Es handelt.
Es hat eine Dichte von 0,779 g/cm3; bei 80,7 ° C kochen; und friert bei 6,4 ° C ein. Es wird im Wasser als unlöslich angesehen, da seine Löslichkeit nur nur 50 ppm betragen kann (ca.) bei Raumtemperatur. Es wird jedoch leicht mit Alkohol, Ether, Chloroform, Benzol und Aceton gemischt.
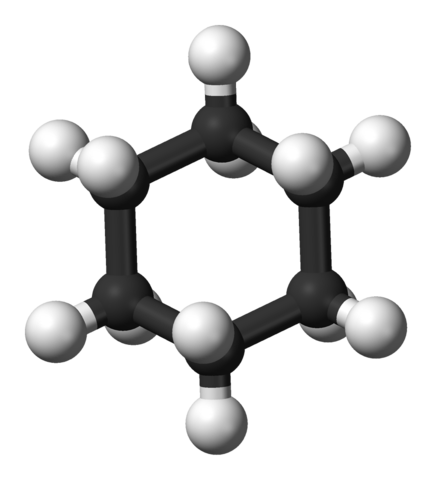
 3D -Modell des Cyclohexanmoleküls. Jynto und Ben Mills / Public Domain
3D -Modell des Cyclohexanmoleküls. Jynto und Ben Mills / Public Domain Cychaxan -Ringsysteme sind unter den organischen Naturmolekülen häufiger als in anderen Cycloalcanos. Dies kann sowohl auf ihre Stabilität als auch auf die Selektivität zurückzuführen sein, die durch seine gut bestehenden Konformationen angeboten wird.
Tatsächlich enthalten Kohlenhydrate, Steroide, Pflanzenprodukte, Pestizide und viele andere wichtige Verbindungen Ringe, die denen des Cyclohexan ähneln, deren Konformationen für ihre Reaktivität von großer Bedeutung sind.
[TOC]
Struktur
Der Cyclohexan ist ein alicyclischer Kohlenwasserstoff mit sechs Mitgliedstücken. Es gibt hauptsächlich in einer Konformation, bei der alle C-H-Bindungen in benachbarten Kohlenstoffatomen gestaffelt sind, wobei die Diedralwinkel von 60 ° entspricht.
Weil es den niedrigsten Winkel und die Spannung der Torsion hat. Dies macht auch den Cyclohexan.
Substituentenpositionen
Es gibt zwei Arten von Positionen für Substituenten im Cyclohexanring: axiale Positionen und äquatoriale Positionen. C-H-Äquatorialverbindungen finden sich in einem Band um den Ecuador des Rings.
Jedes Kohlenstoffatom hat wiederum einen axialen Wasserstoff, der senkrecht zur Ebene des Rings und parallel zu seiner Achse ist. Axiale Hydrogene wechseln sich nach oben und unten; Jedes Kohlenstoffatom hat eine axiale und äquatoriale Position; Und jede Seite des Rings hat drei axiale und drei Äquatorialpositionen in einer alternativen Anordnung.
Kann Ihnen dienen: Natriumcarbonat (Na2co3)Studienmodelle
Cyclohexan untersucht besser ein physikalisches molekulares Modell oder mit einem molekularen Modellierungsprogramm. Wenn eines dieser Modelle verwendet wird, ist es möglich, die Torsionsbeziehungen und die Ausrichtung von Äquator- und Axialwasserstoffatomen leicht zu beobachten.
Die Disposition von Wasserstoffatomen kann jedoch auch in einer Newman-Projektion analysiert werden.
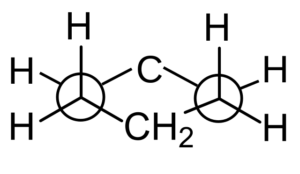 Newman -Projektion aus Cychaxan. Durfo / CC0
Newman -Projektion aus Cychaxan. Durfo / CC0 Konformationen
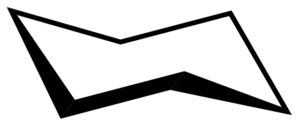
Der Cyclohexan kann in zwei miteinander konvertierbaren Konformationen auftreten: Boot und Stuhl. Letzteres ist jedoch die stabilste Konformation, da in der Struktur des Cyclohexan keine Winkel- oder Torsionspannung vorhanden ist. Mehr als 99% der Moleküle befinden sich zu einem bestimmten Zeitpunkt auf einer Stuhlkonformation.
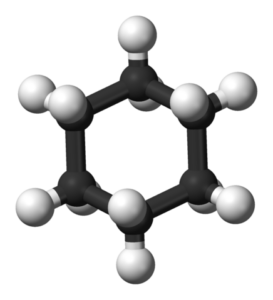
 Konformation von Cychaxan Chair. Chem SIM 2001 / Public Domain
Konformation von Cychaxan Chair. Chem SIM 2001 / Public Domain Stuhlkonformation
In einer Stuhlkonformation betragen alle C-C-Verbindungswinkel 109,5 °, wodurch sie von Winkelspannungen freigesetzt werden. Da C-C-Verbindungen vollkommen gestaffelt sind, ist die Konformation des Stuhls auch frei von Torsionspannungen. Darüber hinaus sind Wasserstoffatome in den gegenüberliegenden Ecken des Cyclohexanrings auf das Maximum getrennt.
Bootsbildung
Die Konformation des Stuhls kann eine andere Form bezeichnen, die als Bootsformation bezeichnet wird. Dies geschieht durch teilweise Rotationen auf einfachen C-C-Bindungen des Rings. Eine solche Konformation hat auch keine Winkelspannung, hat aber eine Torsionspannung.
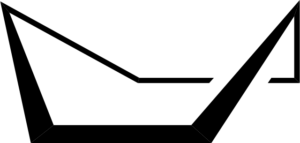 Cyclohexan -Bootskonformation. Keministi / Public Domain
Cyclohexan -Bootskonformation. Keministi / Public Domain Wenn Sie ein Modell der Konformation des Bootes in den C-C-Verbindungsachsen entlang jeder Seite sehen, wird festgestellt, dass die C-H-Bindungen in diesen Kohlenstoffatomen in den Schatten gestellt werden, wodurch Torsionspannungen erzeugt werden.
Es kann Ihnen dienen: BenzolderivateDarüber hinaus sind zwei der Wasserstoffatome nahe genug voneinander, um die Abstoßungskräfte von Van der Waals zu erzeugen.
Gauner
Wenn die Bootskonformation gebeugt wird, wird die Konformation des krummen Bootes, der einen Teil der Torsionspannung lindern und auch Wechselwirkungen zwischen Wasserstoffatomen verringern kann.
Die durch Flexion erhaltene Stabilität reicht jedoch nicht aus, um die Konformation von krummen Boot stabiler zu gestalten als die Konformation des Stuhls.
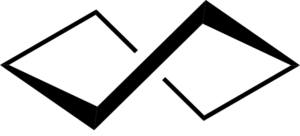 Cyclohexan crooly bootkonformation. Keministi / CC0
Cyclohexan crooly bootkonformation. Keministi / CC0 Anwendungen
Nylonherstellung
Fast der gesamte Cyclohexan, der kommerziell auftritt (mehr als 98%). 75% der weltweit produzierten Caprolactam werden zur Herstellung von Nylon 6 verwendet.
 Gitarre mit Nylonseilen. Quelle: Pexels.com
Gitarre mit Nylonseilen. Quelle: Pexels.com Herstellung anderer Verbindungen
Der Cyclohexan wird jedoch auch zur Herstellung von Benzol, Cyclohexylchlorid, Nitrocylohexan, Cyclohexanol und Cyclohexanon verwendet; in der Herstellung von festem Kraftstoff; in fungiziden Formulierungen; und in der industriellen Rekristallisation von Steroiden.
Minderheitenanwendungen
Ein sehr kleiner Teil des produzierten Zyklus wird als nicht -polares Lösungsmittel für die chemische und verdünnte Industrie bei polymeren Reaktionen verwendet. Es kann auch als Farbe und Lackentferner verwendet werden; in der Extraktion von ätherischen Ölen; und Glasersatz.
Aufgrund seiner einzigartigen chemischen und konformationseigenen Eigenschaften wird das Cyclohexan auch in analytischen chemischen Labors für Molekulargewichtsbestimmungen und als Standard verwendet.
Herstellung
Traditioneller Prozess
Der Cyclohexan ist in Rohöl in Konzentrationen vorhanden, die zwischen 0 variieren.1 und 1.0%. Daher wurde es früher traditionell durch die fraktionelle Destillation des Benzins produziert, bei dem ein 85% iger Cyclohexankonzentrat durch Überflorität erhalten wurde.
Kann Ihnen dienen: Kohlenstoffatom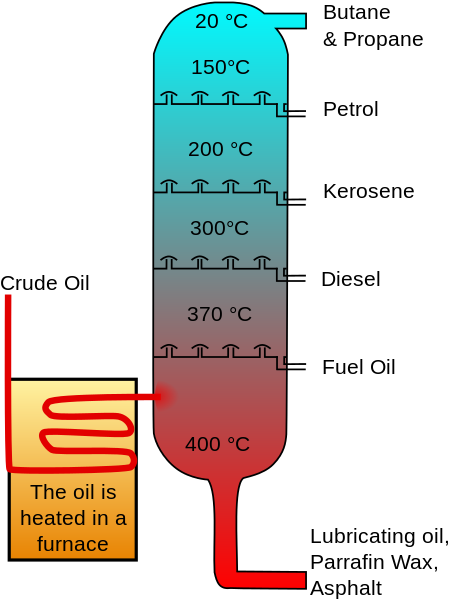 Fraktionierte Öldestillation. Crode_oil_distillation-fr.SVG: Bild Original: Psaria, Theresa Knott; Image Vectorielle: Rogilberterivative Arbeit: Utain ()/CC BY-SA (http: // creativeCommons.Org/lizenzen/by-sa/3.0/)
Fraktionierte Öldestillation. Crode_oil_distillation-fr.SVG: Bild Original: Psaria, Theresa Knott; Image Vectorielle: Rogilberterivative Arbeit: Utain ()/CC BY-SA (http: // creativeCommons.Org/lizenzen/by-sa/3.0/) Dieses Konzentrat wurde verkauft, als zusätzliche Reinigung für die Durchführung eines Isomerisierungsprozesses von Pentanen, Wärmebrissen zur Beseitigung offener Kohlenwasserstoffe und Schwefelsäurebehandlung zur Entfernung aromatischer Verbindungen erforderlich.
Ein Großteil der Schwierigkeit, Cyclohexan mit größerer Reinheit zu erhalten, war auf die große Anzahl von Ölkomponenten mit ähnlichen Siedepunkten zurückzuführen.
Hoher Effizienzprozess
Derzeit tritt das Cyclohexan im industriellen Maßstab durch Reaktion von Benzol mit Wasserstoff (katalytische Hydrierung) aufgrund der Einfachheit des Prozesses und seiner hohen Effizienz auf.
Diese Reaktion kann unter Verwendung von Flüssig- oder Dampfphasenmethoden in Gegenwart eines stark dispergierten Katalysators oder in einem festen katalytischen Bett durchgeführt werden. Es wurden verschiedene Prozesse entwickelt, bei denen Nickel, Platin oder Paladium als Katalysator verwendet werden.
Die meisten Cyclohexanpflanzen verwenden Reformergas, das von Benzol und großen Wasserstoffmengen durch -produkte als Rohstoff für die Cyclohexanproduktion hergestellt wird.
Da die Kosten von Wasserstoff und Benzol für die Herstellung von Cyclohexan auf profitable Weise von entscheidender Bedeutung sind.
Verweise
- Campbell, m. L. (2014). Cyclohexan. Ullmanns Enzyklopädie der industriellen Chemie (7th ed.). New York: John Wiley & Sons.
- McMurry, J. (2011). Grundlagen der organischen Chemie (7th ed.). Belmont: Brooks/Cole.
- Nationales Zentrum für Biotechnologie Information. (2020) Pubchem -Datenbank. Cyclohexan, CID = 8078. Bethesda: National Library of Medicine. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Ouellette, r. J., & Rawn, j. D. (2014). Organische Chemie - Struktur, Mechanismus und Synthese. San Diego: Elsevier.
- Petrucci, r. H., Hering, f. G., Bissonnette, c., & Reifen, j. D. (2017). Allgemeine Chemie: Prinzipien und moderne Anwendungen (11th ed.). New York: Pearson.
- Solomonen, t. W., Fryung, c. B., & Snyder, s. ZU. (2016). Organische Chemie (12th ed.). Hoboken: John Wiley & Sons.
- Wade, l. G. (2013). Organische Chemie (8. Aufl.). New York. Pearson.

