Cyclohexenstruktur, Eigenschaften, Synthese und Verwendung

- 3549
- 344
- Frederike Birkemeyer
Er Cyclohexen Es ist ein Alken- oder zyklischer Olefin, dessen molekulare Formel c ist6H10. Es besteht aus einer farblosen Flüssigkeit, die in Wasser unlöslich und mit vielen organischen Lösungsmitteln mischbar ist. Es ist charakterisiert, indem es brennbar ist und in der Natur normalerweise in Hulla Tar gefunden wird.
Cyclohexen wird durch partielle Hydrierung von Benzol und durch Dehydration von Cyclohexanolalkohol synthetisiert; das heißt, eine oxidiertere Art und Weise. Wie andere Cycloalquene ermittelt es elektrophile Ergänzungen und freie Radikale. Zum Beispiel Halogenierungsreaktion.
 Cyclohexen -Molekül. Quelle: Neurotoger.
Cyclohexen -Molekül. Quelle: Neurotoger. Dieses zyklische (obere Bild) bildet aceotrope Gemische (nicht durch Destillation trennbar) mit unteren Alkoholen und Essigsäure. Es ist bei längerer Lagerung nicht sehr stabil, da es sich unter der Wirkung von Sonnenlicht und ultraviolettem Strahlung zersetzt.
Cyclohexen wird als Lösungsmittel verwendet und hat daher zahlreiche Anwendungen, wie z.
Das Wichtigste ist jedoch, dass das Cyclohexen als Zwischenmaterial und Rohstoff dient, um zahlreiche Verbindungen mit großer Nützlichkeit zu erhalten, darunter: Cyclohexanon, Adipinsäure, Maleinsäure, Cyclohexan, Butyne, Cyclohexylcarboxysäure usw.
[TOC]
Cyclohexenstruktur
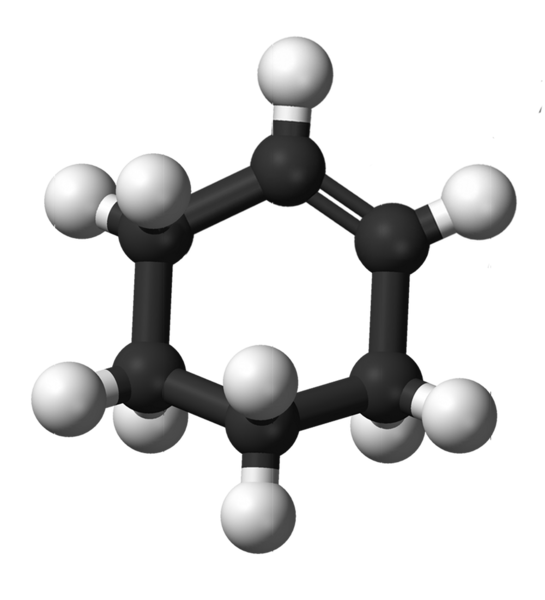 Cyclohexenstruktur. Quelle: Kemikungen [Public Domain]
Cyclohexenstruktur. Quelle: Kemikungen [Public Domain] Das obere Bild zeigt die Struktur des Cyclohexens mit einem Modell von Kugeln und Balken. Sie können den sechs Kohlenstoffring und die Doppelbindung bemerken, beide Unsättigung der Verbindung. Aus dieser Perspektive scheint der Ring flach; Aber es ist überhaupt nicht.
Zu Beginn haben Doppelbindungskohlenstoffe SP -Hybridisierung2, das gibt ihnen eine flache trigonale Geometrie. Daher befinden sich diese beiden Kohlenstoffe und diejenigen, die sie neben ihnen angrenzen, in derselben Ebene; Während die beiden Kohlenstoffe am gegenüberliegenden Ende (zur Doppelbindung) über und unter dieser Ebene sind.
Kann Ihnen dienen: Spezifische SchwerkraftDas minderwertige Bild veranschaulicht perfekt das Neue erklärt.
 Frontansicht der Cyclohexenstruktur. Quelle: Ben Mills.
Frontansicht der Cyclohexenstruktur. Quelle: Ben Mills. Beachten Sie, dass der schwarze Streifen aus vier Kohlenstoffen besteht: die beiden der Doppelbindung und die anderen neben ihnen nebeneinander. Die exponierte Perspektive ist diejenige, die erhalten wird, wenn ein Zuschauer sein Auge direkt vor die Doppelverbindung platziert würde. Es ist dann zu sehen, dass ein Kohlenstoff in dieser Ebene aufgeht.
Da das Cyclohexen -Molekül nicht statisch ist, werden die beiden Kohlenstoffe ausgetauscht: Einer wird untergehen, während der andere über der Ebene steigt. Es wird also erwartet, dass sich dieses Molekül verhalten wird.
Intermolekulare Wechselwirkungen
Cyclohexen ist ein Kohlenwasserstoff, und daher basieren seine intermolekularen Wechselwirkungen auf Londoner Dispersionskräften.
Dies liegt daran, dass das Molekül ohne permanent.
Ebenso erhöht die Doppelbindung den Grad der Wechselwirkung, da sie sich nicht mit der gleichen Flexibilität wie die der anderen Kohlenstoff bewegen kann, und dies begünstigt die Wechselwirkung zwischen benachbarten Molekülen. Aus diesem Grund hat die Cyclohexen einen etwas größeren Siedepunkt (83 ° C) als den des Cyclohexans (81ºC).
Eigenschaften
Chemische Namen
Cyclohexen, Tetrahydribenzol.
Molekulargewicht
82,146 g/mol.
Aussehen
Farblose Flüssigkeit.
Geruch
Süßer Geruch.
Siedepunkt
83 ºC bis 760 mmHg.
Schmelzpunkt
-103,5 ºC.
Zündungspunkt
-7 ºC (geschlossener Tasse).
Wasserlöslichkeit
Praktisch unlöslich (213 mg/l).
Löslichkeit in organischen Lösungsmitteln
Mischbar mit Ethanol, Benzol, Kohlenstofftetrachlor, Ölether und Aceton. Es wird erwartet, dass es in der Lage ist, apolare Verbindungen wie einige der Kohle -Alotrope aufzulösen.
Es kann Ihnen dienen: Torio: Struktur, Eigenschaften, erhalten, verwendet, verwendetDichte
0,810 g/cm3 bei 20ºC.
Dampfdichte
2,8 (mit Luftbeziehung als gleich 1).
Dampfdruck
89 mmHg bei 25ºC.
Selbststeuerung
244 ºC.
Zersetzung
Es zersetzt.
Schmiere
0,625 mpascal bei 25 ° C.
Verbrennungswärme
3.751,7 kJ/mol bei 25 ºC.
Verdampfungswärme
30,46 kJ/mol bei 25 ºC.
Oberflächenspannung
26,26 mn/m.
Polymerisation
Kann unter bestimmten Bedingungen polymerisieren.
Riechschwelle
0,6 mg/m3.
Brechungsindex
1.4465 bis 20 ° C.
pH
7-8 bis 20ºC.
Stabilität
Cyclohexen ist während der langfristigen Lagerung nicht sehr stabil. Leicht- und Luftbelastung kann die Produktion von Peroxiden verursachen. Es ist auch nicht mit starken Oxidationsmitteln kompatibel.
Reaktionen
-Cycloalques erleben hauptsächlich Additionsreaktionen, sowohl elektrophile als auch freie Radikale.
-Reagiert mit Brom, um 1,2-Dibromocyclohexanan zu bilden.
-Es oxidiert in Gegenwart von Kaliumpermanganat (kmno4).
-Es ist in der Lage, ein Epoxid (Cyclohexenoxid) in Gegenwart von Peroxibensäure zu produzieren.
Synthese
Cyclohexen wird durch saure Cyclohexanolkatalyse hergestellt:
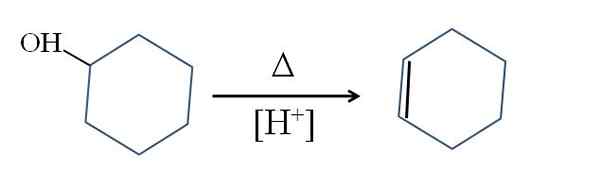 Dehydration des Cyclohexanols. Quelle: Gabriel Bolívar.
Dehydration des Cyclohexanols. Quelle: Gabriel Bolívar. Das δ-Symbol repräsentiert die Wärme, die erforderlich ist, um den Ausgang der OH-Gruppe als Wassermolekül in einem sauren Medium zu fördern (-OH2+).
Cyclohexen tritt auch durch teilweise Hydrierung von Benzol auf; Das heißt, zwei seiner Doppelbindungen fügen ein Wasserstoffmolekül hinzu:
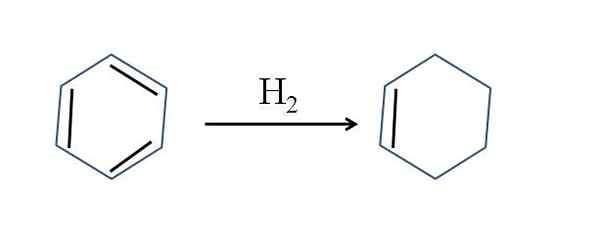 Partielle Hydrierung von Benzol. Quelle: Gabriel Bolívar.
Partielle Hydrierung von Benzol. Quelle: Gabriel Bolívar. Obwohl die Reaktion einfach erscheint, erfordert es großartige h2 und Katalysatoren.
Anwendungen
-Es hat Nutzen als organisches Lösungsmittel. Darüber hinaus ist es ein Rohstoff für die Herstellung von Adipinsäure, adipischer Aldehyd, Maleinsäure, Cyclohexan und Cyclohexylcarboxylsäure.
Kann Ihnen dienen: Radioaktivität-Es wird bei der Herstellung von Cyclohexanchlorid verwendet, die als Vermittler der Herstellung von pharmazeutischen Produkten und dem Reibenadditiv verwendet wird.
-Cyclohexen wird auch zur Synthese von Cyclohexanon, Rohmaterial für die Produktion von Medikamenten, Pestiziden, Parfums und Farbstoffen verwendet.
-Cyclohexen Intervenes in der Synthese von Aminocyclohexanol, einer Verbindung, die als Tensid und Emulgator verwendet wird.
-Darüber hinaus kann Cyclohexen zur Herstellung im Butadieno Laboratory verwendet werden. Diese letzte Verbindung wird bei der Herstellung von synthetischen Gummi bei der Ausarbeitung von Autoreifen verwendet und wird auch bei der Ausarbeitung von Acrylkasten verwendet.
-Cyclohexen ist Rohstoff für die Lysinsynthese, Phenol-, Polycyolefin -Harz- und Gummizusatzstoffe.
-Es wird als Stabilisator von Hoch Oktanzier -Benzinen verwendet.
-Intervenes in die Synthese von wasserdichten Beschichtungen, Filmen, die gegen Risse und Bindungsordner für Beschichtungen resistent sind.
Risiken
Cyclohexen ist keine sehr giftige Verbindung, aber sie kann durch Kontakt eine Rötung von Haut und Augen verursachen. Seine Inhalation kann Husten und Schläfrigkeit erzeugen. Darüber hinaus kann seine Einnahme Schläfrigkeit, Atembeschwerden und Übelkeit verursachen.
Cyclohexen ist im Magen -Darm -Trakt wenig absorbiert, so dass schwerwiegende systemische Effekte aufgrund seiner Aufnahme nicht zu erwarten sind. Die maximale Komplikation ist das Aspiration um das Atmungssystem, das chemische Lungenentzündung erzeugen kann.
Verweise
- Joseph f. Chiang und Simon Harvey Bauer. (1968). Molekülstruktur von Cyclohexen. J. BIN. Chem. SOC. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyclohexen: Gefahren, Synthese und Struktur. Lernen. Erholt von: Studium.com
- Morrison, r. T. Und Boyd, r. N. (1987). Organische Chemie. (5ta Auflage.). Editorial Addison-Wesley Iberoamericana.
- Pubchem. (2019). Cyclohexen. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Chemisches Buch. (2019). Cyclohexen. Erholt von: Chemicalbook.com
- Toxicology Data Network. (2017). Cyclohexen. Toxnet. Wiederhergestellt von: Toxnet.NLM.NIH.Regierung
- Chemoxie. (S.F.). Die strukturelle Formel für Cyclohexen ist. Erholt von: Chemoxy.com
- « Doppelte moralische Definition, Beispiele und Konsequenzen
- Real gelegener Hintergrund und Geschichte »

