Cycloxygenase -Typen, Reaktion, Inhibitoren
- 4675
- 142
- Timo Rabenstein
Der Cycloxygenasen (COXS), auch als Prostaglandin H -Synthase oder Prostaglandin -Endoperoxid -Synthesas bekannt, sind Oxygenase -Fettsäure -Enzyme, die zur Myeloperoxidase -Superfamilie gehören und bei allen Wirbeltieren vorkommen.
Cycoxygenasen sind bifunktionelle Enzyme, da sie zwei verschiedene katalytische Aktivitäten haben: eine Cyclooxygenase -Aktivität und eine andere Peroxidase, die es ihnen ermöglicht, die katalysieren zu können Bis-Oxygenierung und Arachidonsäure -Reduktion zur Bildung von Prostaglandin.
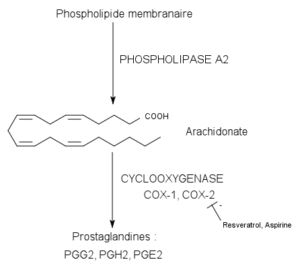 Katalisierte Reaktion durch Cycloxygenase-Enzyme (Quelle: Pancrat [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Katalisierte Reaktion durch Cycloxygenase-Enzyme (Quelle: Pancrat [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Sie wurden nicht in Pflanzen, Insekten oder in einzelligen Organismen gefunden, sondern in Wirbeltierzellen dieses Enzym, Vesikel usw.
Die ersten Erkennungen der von den Cyclooxygenasen synthetisierten Produkten wurden in Samenflüssigkeiten durchgeführt, sodass zunächst angenommen wurde, dass es in der Prostata hergestellt wurde, weshalb sie "Prostaglandine" genannt wurden.
Heute ist bekannt, dass Prostaglandine in allen Geweben von Wirbeltieren und sogar in Organismen, die keine Prostatadrüsen haben Empfindlichkeit gegenüber Schmerzen oder Algees, Entzündung, Thrombose, Mytogenese, Vasodilatation und Vasokonstriktion, Eisprung. Nierenfunktion usw.
[TOC]
Leute
Die Existenz von zwei Arten von Cyclooxygenasen zwischen Wirbeltieren wurde berichtet. Der erste, der entdeckt und gereinigt wird.
Die zweite Cycloxigenase, die unter den Eukaryoten entdeckt wurde. Bisher wurde nachgewiesen, dass alle Wirbeltiertiere, einschließlich knorpeliger Fisch, Knochenfische, Vögel und Säugetiere, zwei Gene haben, die für Cox -Enzyme kodieren.
Es kann Ihnen dienen: Pilzkreislauf: Nährstoffe, Substanzen, OsmoregulationEiner von ihnen, COX-1, Codes für Cyclooxigenase 1, die konstitutiv ist, während das Gen COX-2 codiert für induzierbare Cyclooxygenase.
Eigenschaften beider Gene und ihrer enzymatischen Produkte
COX-1- und COX-2-Enzyme sind ziemlich ähnlich, was als 60-65% Ähnlichkeit zwischen seinen Aminosäuresequenzen verstanden wird.
Die Gene COX-1 Orthologen (Gene in verschiedenen Arten, die den gleichen Ursprung haben) in allen Arten von Wirbeltieren produzieren COX-1 COX-2, deren Produkte haben eine Identität zwischen 70 und 90%.
Cnidarier und Ascidias haben auch zwei Gene Cox, Diese unterscheiden sich jedoch von denen anderer Tiere, daher nehmen einige Autoren an, dass diese Gene bei unabhängigen Duplikationsereignissen aus demselben gemeinsamen Vorfahren entstehen können.
COX-1
Das Gen Cox-1 wiegt ungefähr 22 kb und wird konstitutiv ausgedrückt, um das COX-1-Protein mit etwa 600 Aminosäureabfällen zu codieren.
Dieses Protein befindet sich haupt.
COX-2
Das Gen Cox-2 wiegt dagegen etwa 8 kb und seine Expression wird durch Zytokine, Wachstumsfaktoren und andere Substanzen induziert. Dies kodiert für das COX-2.
Kann Ihnen dienen: anaerobe AtmungDieses Enzym ist auch homodimerisch und liegt zwischen dem endoplasmatischen Retikulum und dem Kerngepackt.
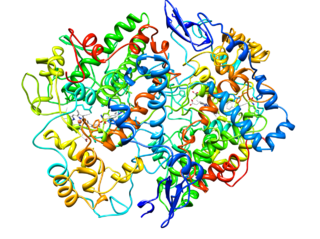
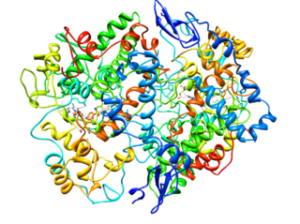 Molekulare Struktur der Cycloxygenase vom Typ 2 (COX-2) (Quelle: Cytochrom C bei englischer Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Molekulare Struktur der Cycloxygenase vom Typ 2 (COX-2) (Quelle: Cytochrom C bei englischer Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Aus der Analyse ihrer Strukturen wurde festgestellt, dass COX-1- und COX-2-Enzym Englisch Epidermaler Wachstumsfaktor).
In diesem Modul befinden sich extrem erhaltene Disulfidbindungen oder Brücken, die als „Dimerisierungsdomäne“ zwischen den beiden Polypeptiden jedes homodimeren Enzyms fungieren.
Proteine haben auch amphipatische Propeller, die die Verankerung einer der Membranschichten erleichtern. Darüber hinaus hat die katalytische Domäne beider zwei aktive Stellen, eines mit Cyclooxygenaseaktivität und eine mit Peroxidaseaktivität.
Beide Enzyme sind extrem erhaltene Proteine und gehören zu verschiedenen Arten, die wenig signifikante Unterschiede in Bezug auf die Mechanismen der Dimerisierung und Vereinigung zur Membran sowie einige Merkmale ihrer katalytischen Domänen haben.
Cox -Proteine haben zusätzlich Glykosylierungsstellen, die für ihren Betrieb unerlässlich sind und absolut erhalten bleiben.
Reaktion
Cycloxygenase-Enzyme 1 und 2 sind dafür verantwortlich, die ersten beiden Schritte der Prostaglandin-Biosynthese zu katalysieren, die mit der Umwandlung von Arachidonsäure in Vorläufer von Prostaglandinen beginnen, die als Hydroperoxi-Endoperoxid PGG2 bekannt sind.
Damit diese Enzyme ihre Funktionen ausüben können, müssen sie zunächst durch einen Prozess aktiviert werden, der von ihrer Peroxidase -Aktivität abhängt. Mit anderen Worten, seine Hauptaktivität hängt von der Verringerung eines Peroxidsubstrats (vermittelt durch die aktive Peroxidasestelle) ab, so dass die Oxidation des mit der HEMO -Gruppe assoziierten Eisengruppe, der als Cofaktor dient.
Es kann Ihnen dienen: Monera Kingdom: Merkmale, Klassifizierung und BeispieleDie Oxidation der Hämogruppe führt zur Bildung eines Tyrosil -Radikals in der Cycloxygenase des aktiven Zentrums, das das Enzym aktiviert und die Initiierung der Cyclooxygenase -Reaktion fördert. Diese Aktivierungsreaktion kann nur einmal auftreten, da das Tyrosil -Radikal während der letzten Reaktion des Weges regeneriert wird.
Inhibitoren
Cycloxygenasen sind an der Synthese von Prostaglandinen beteiligt, die Hormone mit Funktionen beim Schutz der Darmschleimhaut sind.
Angesichts der Tatsache, dass diese Enzyme der Schlüssel zur Herstellung dieser Hormone sind, insbesondere solche, die mit entzündlichen Prozessen zu tun haben, haben sich zahlreiche pharmakologische Studien auf die Hemmung von Cyclooxygenasen konzentriert.
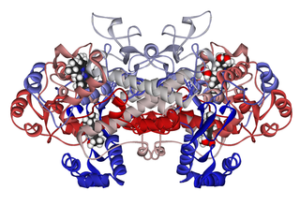 Molekulare Struktur von Cycloxigenase 1, die mit Ibuprofen verbunden ist (Quelle: Fvasconcellos 5. Mai 2007 [Public Domain] über Wikimedia Commons)
Molekulare Struktur von Cycloxigenase 1, die mit Ibuprofen verbunden ist (Quelle: Fvasconcellos 5. Mai 2007 [Public Domain] über Wikimedia Commons) Somit wurde gezeigt, dass der Wirkungsmechanismus vieler nichtsteroidaler entzündungshemmender Arzneimittel mit irreversiblen oder reversiblen (inhibitorischen) Acetylierung der Cyclooxigenase der aktiven Stelle in diesen Enzymen zu tun hat.
Unter diesen Medikamenten befinden sich Piroxicam, Ibuprofen, Aspirin, Flurbiprofen, Diclofenac, Naproxen und andere.
Verweise
- Botting, r. M. (2006). Inhibitoren von Cyclooxygenasen: Mechanismen, Selektivität und Verwendung. Journal of Physiology and Pharmacology, 57, 113.
- Chandrasekharan, n. V., & Simmons, D. L. (2004). Die Cycloxygenasen. Genombiologie, 5 (9), 241.
- Fitzpatrick, f. ZU. (2004). Cyclooxygenase -Enzyme: Regulation und Funktion. Aktuelles pharmazeutisches Design, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, l., & Fulton, zu. M. (2002). Cyclooxygenase -Inhibitoren blockieren das Zellwachstum, erhöhen Ceramid und hemmen den Zellzyklus. Brustkrebsforschung und -behandlung, 76 (1), 57-64.
- Rauzer, c. ZU., & Marnett, l. J. (2009). Cycloxygenasen: strukturelle und funktionelle Erkenntnisse. Journal of Lipid Research, 50 (Supplement), S29-S34.
- Vane, j. R., Bakhle und. S., & Boting, r. M. (1998). Cycloxysges 1 und 2. Jährlicher Überblick über Pharmakologie und Toxikologie, 38 (1), 97-120.
- « Überwasser verursacht Ursachen, Effekte und Lösungen
- Die 101 besten Mikrogeschichten für junge Menschen und Erwachsene »

