Borsäure -chemische Struktur, Eigenschaften, Vorbereitung, verwendet, verwendet

- 4853
- 956
- Luca Holdt
Er Borsäure Es ist eine anorganische Verbindung, deren chemische Formel H ist3Bo3. Es besteht aus einem weißen oder farblosen Feststoff. Es ist eine schwache Säure, die in wässriger Lösung je nach Konzentration einen pH -Wert zwischen 3,8 und 4,8 erzeugt. Es ist wenig löslich in kaltem und mäßig löslichem heißem Wasser.
Die Borsäure wurde 1702 von Wilhelm Man entdeckt.
 Feste Probe von Borsäure auf Taktglas. Quelle: Walkerma über Wikipedia.
Feste Probe von Borsäure auf Taktglas. Quelle: Walkerma über Wikipedia. Es wird jedoch auch darauf hingewiesen, dass Boerg die Borsäure durch Zugabe von Wasser in die Borax und Erhitzen der Lösung zur Verdampfen des Sediments Die Cryal -Säure -Kristalle vorbereitet.
Diese Säure ist eine sehr nützliche Verbindung, die zahlreiche Anwendungen in Industrie und Medizin hat, die ebenfalls als Insektizid, Erhaltung von Holz, Verzögerung von Feuer verwendet werden und ein Bestandteil einer PH -Dämpfungslösung ist.
[TOC]
Chemische Struktur
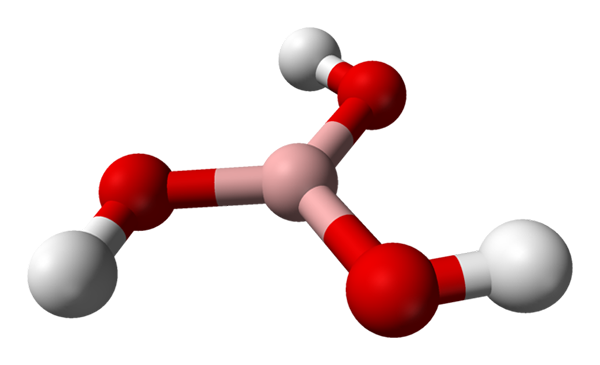 Borsäuremolekül, das durch ein Kugeln und Balkenmodell dargestellt wird. Quelle: Benjah-BMM27 [Public Domain]
Borsäuremolekül, das durch ein Kugeln und Balkenmodell dargestellt wird. Quelle: Benjah-BMM27 [Public Domain] Im überlegenen Bild haben wir das Molekül selbst von H3Bo3. Beachten Sie, dass Wasserstoffatome, die durch weiße Kugeln dargestellt werden, nicht mit dem zentralen Boratom verbunden sind, ebenso wie die chemische Formel; vielmehr zu Sauerstoffatomen, dargestellt durch rote Kugeln.
Somit ist eine bequemere Formel, obwohl weniger verwendet, für Borsäure b (OH)3, Angeben, dass ihre Säure auf H -Ionen zurückzuführen ist+ Befreit von ihren OH -Gruppen. Molekula B (OH)3 Es hat eine trigonale flache Geometrie mit seinem Boratom eine chemische Hybridisierung SP2.
Das b (oh)3 Es ist ein kovalentes hohes Molekül, da der Unterschied in der Elektronegativität zwischen dem Boratom und dem Sauerstoff nicht sehr groß ist; Die B-O-Links sind also im Wesentlichen kovalent. Beachten Sie, dass die Struktur dieses Moleküls der eines Spinners ähnelt. Kann ich Ihre eigene Achse auf die gleiche Weise einschalten??
Kristalle
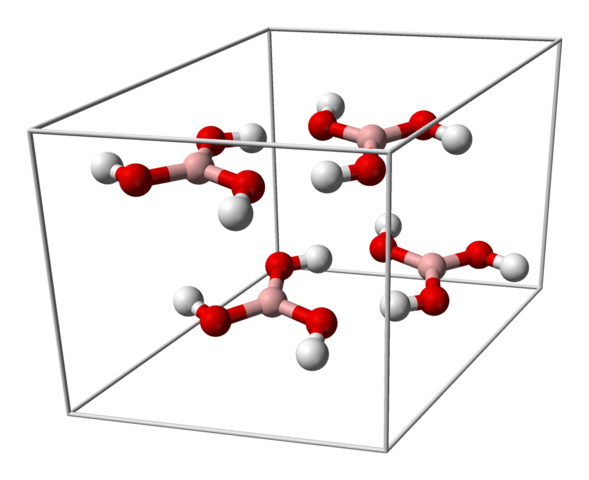 Einheitliche Zelle für H3BO3 -Kristall. Quelle: Benjah-BMM27 [Public Domain]
Einheitliche Zelle für H3BO3 -Kristall. Quelle: Benjah-BMM27 [Public Domain] Das obere Bild zeigt die einheitliche Zelle, die der Trizycling -Kristallstruktur für Borsäure entspricht, die unter bestimmten Synthesebedingungen die kompakte hexagonale Struktur übernehmen kann. Beachten Sie, dass es vier Moleküle pro einheitlicher Zelle gibt und die in zwei Schichten A und B geordnet sind (sie sind nicht übereinander überlagert).
Aufgrund der Symmetrie und Anleitung von B-OH-Verbindungen kann angenommen werden, dass B (OH)3 Es ist apolar; Die Existenz von intermolekularen Wasserstoffbrücken verändert jedoch die Geschichte. Jedes B (OH) -Molekül3 Drei dieser Brücken geben oder empfangen, mit insgesamt sechs Dipol-Dipolo-Wechselwirkungen, wie sie im Bild unten beobachtet werden:
Kann Ihnen dienen: Terpenos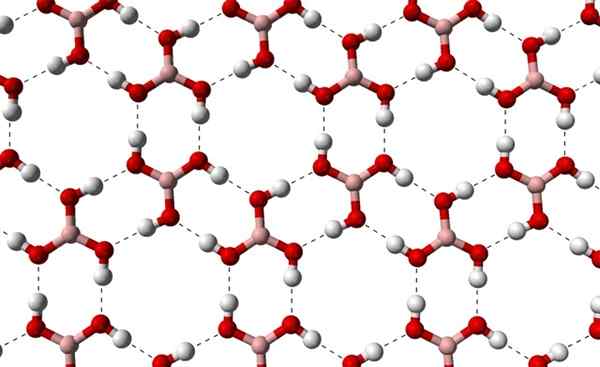 Kristalline Schichten von H3BO3, die aus einer höheren Achse beobachtet wurden. Quelle: Benjah-BMM27 [Public Domain]
Kristalline Schichten von H3BO3, die aus einer höheren Achse beobachtet wurden. Quelle: Benjah-BMM27 [Public Domain] Beachten Sie, dass diese Wasserstoffbrücken die Richtungswechselwirkungen sind, die Borsäurkristalle regeln und Muster von Zieraspekten herstellen; Innere Ringe vielleicht mit ausreichend Platz, um einige Verunreinigungen zu verschließen, die sich nicht in kristallinen Defekten befinden.
Diese Wasserstoffbrücken trotz der niedrigen molekularen Masse von B (OH)3, Sie halten ihr Glas so kohärent, dass er eine Temperatur von 171 ° C benötigt, um zu schmelzen. Es ist nicht bekannt, welche Effekte hohen Drücken (in der Größenordnung des GPA) auf die molekularen Schichten von B (OH) haben würden3.
Eigenschaften
Namen
IUPAC: Borsäure und Trihydrooxidobor. Andere Namen: Orthoborsäure, Borracinsäure, Sassolit, Borofax und Trihydroxiborano.
Molmasse
61,83 g/mol
Aussehen
Kristalliner, farbloser und transparenter weißer Feststoff. Es wird auch als Granulat oder in Form von weißem Staub erreicht. Etwas nicht zu berühren.
Geruch
Toilette
Geschmack
Etwas bitter
Schmelzpunkt
170,9 ºC
Siedepunkt
300 ºC
Wasserlöslichkeit
Mäßig löslich in kaltem und löslichem Wasser in heißem Wasser:
2,52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
Borsäure ist teilweise löslich im Wasser und neigt dazu, in sie zu sinken. Diese Löslichkeit nimmt im Vorhandensein von Säuren wie Hydrochlorisch, Zitronen und Tartaric zu.
Löslichkeit in anderen Lösungsmitteln
-Glycerin: 17,5 % bei 25 ° C
-Ethylenglykol: 18,5 % bei 25 ° C
-Aceton: 0,6 % bei 25 ° C
-Ethylacetat: 1,5 % bei 25 ° C
-Methanol: 172 g/l a 25 ºC
-Ethanol: 94,4 g/l a 25 ºC
Oktanol/Wasserpartitionskoeffizient
Log p = -0,29
Säure (PKA)
9.24. 12.4. 13.3. Dies sind die drei Konstanten ihrer jeweiligen Dissoziationen, um H freizusetzen+ Im Wasser.
pH
3,8 - 4,8 (3,3 % in wässriger Lösung)
5.1 (0,1 Molar)
Dampfdruck
1,6 · 10-6 mmhg
Stabilität
Stabil im Wasser
Zersetzung
Es bricht nieder.
Reaktivität
Borsäureform lösliche Salze mit monovalenten Kationen, zum Beispiel: NA2B4ENTWEDER7.10H2Oder, und unlösliche Salze mit trennen Kationen, Taxi4ENTWEDER7.6h2ENTWEDER.
In wässriger Lösung erzeugt es eine saure Lösung, da diese Eigenschaft auf die Subtraktion von OH -Gruppen zurückzuführen ist- vom Wasser. Borsäure ist als schwache Säure des Lewis -Typs qualifiziert.
Borsäure reagiert mit Glycerin und Mannitol, wodurch die Säure der wässrigen Umgebung erhöht wird. PKA wird aufgrund der Bildung von Boro-Manitol Quelato [BC von 9,2 bis 5 modifiziert6H8ENTWEDER2(OH)2]-, was freisetzt h+.
Vorbereitung
Borsäure befindet sich in vulkanischen Emanationen in Regionen wie der Toskana Italiens, Lipari -Inseln und im Bundesstaat Nevada, USA. Es kommt auch in Mineralien wie Borax, Boracita, Uexita und Colemanita vor.
Kann Ihnen dienen: HalogenenBorsäure wird hauptsächlich durch die Reaktion des Borax -Minerals (Natrium -Natriumtetrabat) mit Mineralsäuren wie Salzsäure, Schwefelsäure usw. hergestellt.
N / A2B4ENTWEDER9· 10H2O +hcl => 4 h3Bo3 + 2 NaCl +5 h2ENTWEDER
Es wird auch durch die Hydrolyse von Boro und Diborano Trihaluro hergestellt.
Borsäure wird aus Collemanit (CA) hergestellt2B6ENTWEDERelf· 6 h2ENTWEDER). Das Verfahren besteht in der Behandlung von Mineral mit Schwefelsäure zur Auflösen von Borverbindungen.
Dann ist die Lösung, bei der die Borsäure der abgewickelten Fragmente vorhanden ist. Die Wasserstoffsulfidlösung wird behandelt, um die Unreinheiten von Arsen und Eisen auszurüsten. Der Überstand ist abgekühlt, um einen Niederschlag von Borsäure zu erzeugen und ihn von der Suspension zu trennen.
Anwendungen
In der Industrie
Borsäure wird in der Glasfaserausarbeitung verwendet. Durch die Verringerung des Schmelzpunkts erhöht es die Stärke und Effizienz von Textilfaserglas: Material, das zur Verstärkung des Kunststoffs, der in Gefäßen, Industrierohren und Computerschaltungen verwendet wird, verwendet wird.
Borsäure beteiligt sich an der Herstellung von borosilisiertem Glas, das es ermöglicht, ein glasfestes Glas zu erhalten, das in Haushaltskuisin, im Glasmaterial von Labors, Fluoreszenzrohre, Faseroptik, LCD -Bildschirmen usw. verwendet werden kann.
Es wird in der metallurgischen Industrie verwendet, um Stahllegierungen zu härten und zu behandeln sowie die Metallfutter von Materialien zu bevorzugen.
Es wird als chemische Komponente beim hydraulischen Bruch (Fracking) verwendet: Methode, die bei der Öl- und Gasextraktion verwendet wird. Borsäure wirkt als Feuerschutzmittel in Cellulosematerialien, Kunststoffen und Textilien, die mit Borsäure imprägniert sind, um ihren Brandresistenz zu erhöhen.
In Behandlung
Borsäure wird im Augenwaschen verdünnt. Zur Behandlung von Pilzinfektionen, insbesondere Candida albicans, werden Borsäurgelatinenkapseln verwendet. Es wurde auch bei der Behandlung von Akne eingesetzt.
Borsäure wird in Socken bestreut, um Füßeinfektionen wie den Fuß des Athleten zu verhindern. Ebenso werden Lösungen, die Borsäure enthalten.
Borsäure wird in den für die Urinsammlung verwendeten Flaschen zugegeben, was eine bakterielle Kontamination verhindert, bevor er in diagnostischen Labors untersucht wird.
Es kann Ihnen dienen: Indolaleticsäure: Struktur, Eigenschaften, erhalten, verwendet, verwendetInsektizid
Borsäure wird zur Kontrolle der Insektenproliferation wie Kakerlaken, Termiten, Ameisen usw. verwendet. Die Kakerlaken töten nicht sofort, da sie zuerst ihre Verdauungs- und Nervensysteme beeinflusst, zusätzlich zur Zerstörung ihres Exoskeletts.
Borsäure übt ihre Wirkung langsam aus, wodurch Insekten, die sie aufgenommen haben, mit anderen Insekten in Kontakt kommen und so die Vergiftung verbreiten.
Erhaltung
Borsäure wird verwendet, um den Holzangriff durch Pilze und Insekten zu verhindern, und verwendet zu diesem Zweck in Verbindung mit Ethylenglykol. Diese Behandlung ist auch bei der Kontrolle von Schlick und Algen wirksam.
PH -Stoßdämpfer
Borsäure und ihre konjugierte Basis bilden ein PKA -Dämpfungssystem = 9,24, was darauf hinweist. Der Borato -Stoßdämpfer wird jedoch in der pH -Regulierung in Pools verwendet.
Kernreaktoren
Borsäure hat die Fähigkeit, thermische Neutronen zu fangen, was die Möglichkeit einer nicht kontrollierten Kernspaltung verringert, die Kernunfälle erzeugen kann.
Landwirtschaft
Boro ist ein wesentliches Element für das Pflanzenwachstum, das die Verwendung von Borsäure für den Beitrag des Elements induzierte. In überschüssigen Borsäure kann jedoch Pflanzen schädigen, insbesondere Zitrusfrüchte.
Kontraindikationen
Die Verwendung von Borsäure auf der abgeschrägten Haut-, Wunden- oder Verbrennungsprodukt, die die Absorption derselben ermöglicht, muss vermieden werden. Dies ist eine toxische Verbindung im Körper und in einigen Fällen kann sie Ohnmacht, Anfälle, Krämpfe, Gesichtszeiger und arterielle Hypotonie verursachen.
Der Arzt sollte zur Verwendung von Borsäurebaginalkapseln bei schwangeren Frauen konsultiert werden, da darauf hingewiesen wurde.
Die Platzierung von Borsäure, die als Insektizid verwendet wird, an Orten, die Kindern zur Verfügung stehen.000 bis 3.000 mg.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). BORSÄURE. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). BORSÄURE. Pubchem -Datenbank. CID = 7628. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Die Herausgeber von Enyclopaedia Britannica. (28. März 2019). BORSÄURE. Encyclopædia Britannica. Erholt von: Britannica.com
- Träger vibrieren. (9. November 2018). Die verborgenen USSE -Säure in Ihrem täglichen Leben. Wiederhergestellt von: Carriervibrieren.com
- Nationales Pestizidinformationszentrum. (S.F.). BORSÄURE. Erholt von: npic.Orst.Edu
- Abfassung. (30. November 2017). Borsäure: Eigenschaften und Verwendungen dieser chemischen Verbindung. Abgerufen aus: Säuren.Die Info
- Chlorurosodium. (2019). Borsäure. Erholt von: Chlorurosodium.com
- Spanische Gesellschaft für Krankenhaus Apotheke. (S.F.). Borsäure. [PDF]. Abgerufen aus: Arbeitsgruppen.Sefh.Ist
- « OPTISCHER Vergleicher Was ist die Verwendung von und Teilen
- 11 Vorteile des Recyclings in der Gesellschaft (mit Beispielen) »

