Carboxylsäure
- 2473
- 618
- Medine Kedzierski
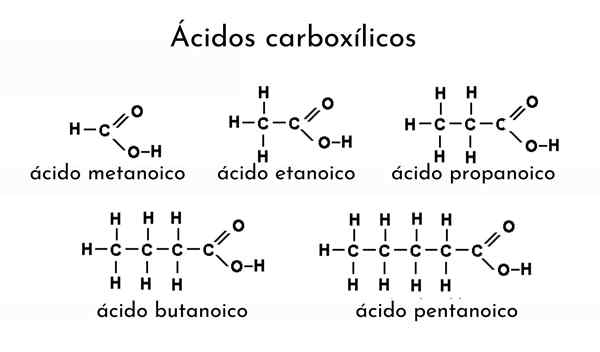
 Beispiele für Carboxsäuren
Beispiele für Carboxsäuren Was sind Carboxsäuren?
Er Carboxylsäure Es ist ein Begriff, der einer organischen Verbindung zugeschrieben wird, die eine Carboxylgruppe enthält. Sie können auch als organische Säuren bezeichnet werden und sind in vielen natürlichen Quellen vorhanden. Zum Beispiel von Ameisen und anderen Insekten wie Galeritkäfern, Ameisensäure wird eine Carbonsäure destilliert.
Das heißt, eine Anthill ist eine Quelle, die reich an Ameisensäure ist. Außerdem wird Essigsäure aus dem Essig extrahiert, der Geruch von ranzigem Butter ist auf Butschänensäure, Valeria -Kräuter zurückzuführen.
Milchsäure gibt den schlechten Geschmack von saurer Milch, und in einigen Fetten und Ölen sind die Fettsäuren vorhanden. Die Beispiele für natürliche Quellen von Carboxylsäuren sind unzählige, aber alle ihre zugewiesenen Namen stammen aus Wörtern in Latein. So im Latein das Wort Formica bedeutet "Ameise".
Da diese Säuren in verschiedenen Kapiteln der Geschichte extrahiert wurden, waren diese Namen häufig und konsolidieren in der Populärkultur.
Formel
Der Die allgemeine Formel von Carboxylsäure ist -r -Cooh, oder mehr Details: R- (c = o) -Oh. Das Kohlenstoffatom ist mit zwei Sauerstoffatomen verbunden, was zu einer Abnahme seiner elektronischen Dichte und folglich eine positive Teilbelastung führt.
Diese Last spiegelt den Kohlenstoffoxidationsstatus in einer organischen Verbindung wider. In jedem anderen ist Kohlenstoff so rostig wie im Fall von Carboxylsäuren, wobei diese Oxidation proportional zum Reaktivitätsgrad der Verbindung ist.
Aus diesem Grund hat die Gruppe -Cooh die Dominanz gegenüber anderen organischen Gruppen und definiert die wichtigste kohlensäurehaltige Natur und die wichtigste kohlensäurehaltige Kette der Verbindung.
Daher gibt es keine Säurederivate von Aminen (R-NH2), aber Aminos, die aus Carboxsäuren (Aminosäuren) abgeleitet wurden, stammen ab.
Nomenklatur
Bongige Namen, die aus Latein für Carboxylsäuren abgeleitet sind.
Angesichts der Notwendigkeit dieser Klarstellungen entsteht die systematische IUPAC -Nomenklatur, um Carboxylsäuren zu benennen.
Kann Ihnen dienen: Brom: Geschichte, Struktur, elektronische Konfiguration, Eigenschaften, verwendetDiese Nomenklatur unterliegt mehreren Regeln, einige davon sind:
Regel 1
Um eine Carbonsäure zu erwähnen, muss der Name seines Alkans durch Hinzufügen des ICO -Suffix modifiziert werden. So für Ethane (wählen Sie3-CH3) Seine entsprechende Carbonsäure ist Ethansäure (CH3-Cooh, Essigsäure, das gleiche von Essig).
Ein weiteres Beispiel: für Cho3CH2CH2-Cooh El Alcano wird Butan (Ch3CH2CH2CH3) und deshalb wird Butanonsäure (Buttersäure, das gleiche von ranzigem Butter) ernannt.
Regel 2
Die -kooh -Gruppe definiert die Hauptkette, und die Zahl, die jedem Kohlenstoff entspricht.
Zum Beispiel Cho3CH2CH2CH2-COOH ist Pentansäure, die von ein bis fünf Kohlenstücken zum Methyl zählt (wählen Sie3). Wenn eine andere Methylgruppe mit dem dritten Kohlenstoff verbunden ist, wäre es Cho3CH2Ch (Ch3) CH2-COOH ist die resultierende Nomenklatur jetzt: 3-Methylpentansäure.
Regel 3
Den Substituenten gehen die Anzahl des Kohlenstoffs voraus, mit dem sie verbunden sind. Ebenso können diese Substituenten doppelte oder dreifache Links sein und das ICO -Suffix zu Alkenen und Alkinen zu gleichen Teilen hinzufügen. Zum Beispiel Cho3CH2CH2CH = CHCH2-COOH wird als Säure (cis oder trans) 3-Heptenoic erwähnt.
Regel 4
Wenn die R -Kette aus einem Ring besteht (φ). Die Säure wird beginnend mit dem Namen des Rings und dem enden mit dem "Carboxyl" -Suffix endet. Zum Beispiel wird der φ-Cooh als Benzecenocarbonsäure bezeichnet.
Carbonsäurestruktur
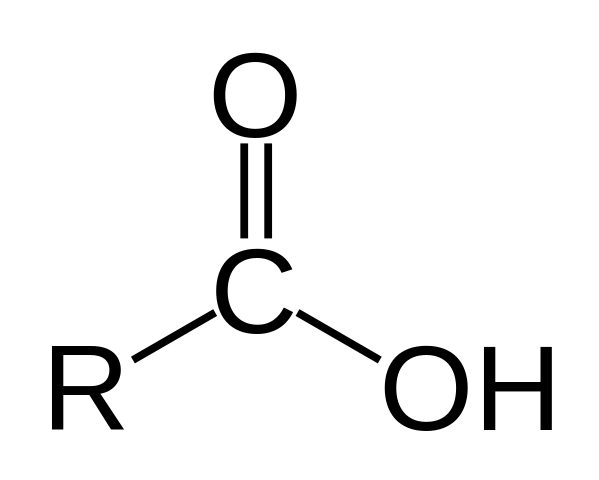 Struktur einer Carbonsäure. R ist eine Wasserstoff oder kohlensäurehaltige Kette.
Struktur einer Carbonsäure. R ist eine Wasserstoff oder kohlensäurehaltige Kette. Im oberen Bild wird die allgemeine Struktur von Carbonsäure dargestellt. Seitenkette R kann in jeglicher Länge sein oder alle Arten von Substituenten besitzen.
Das Kohlenstoffatom hat SP -Hybridisierung2, Dadurch können Sie eine Doppelbindung akzeptieren und Verbindungswinkel von ungefähr 120 ° erzeugen.
Daher kann diese Gruppe als flaches Dreieck assimiliert werden. Der obere Sauerstoff ist reich an Elektronen, während der untere Wasserstoff in Elektronen schlecht ist und zu einem sauren Wasserstoff (Elektronenakzeptor) wird. Dies ist in doppelten Bindungsresonanzstrukturen beobachtbar.
Wasserstoff wird einer Base zugeordnet, und aus diesem Grund entspricht diese Struktur einer sauren Verbindung.
Kann Ihnen dienen: AmineCarbonsäureeigenschaften
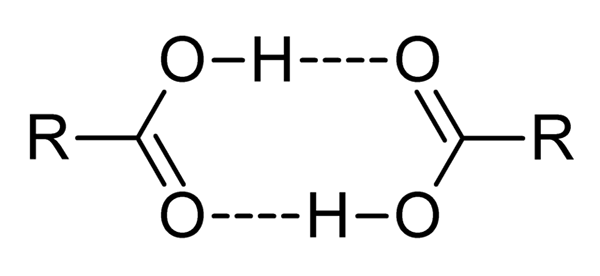
Carboxylsäuren sind sehr polare Verbindungen, intensive Gerüche und mit der einfachen Wechselwirkung miteinander durch Wasserstoffbrücken, wie durch das überlegene Bild dargestellt.
Wenn zwei Carbonsäuren auf diese Weise interagieren, werden Dímeros gebildet, einige stabil genug, um in einer Gasphase zu existieren.
Wasserstoff- und Durchmesserbrücken verursachen Carbonsäuren mit höheren Siedepunkten als Wasser. Dies liegt daran.
Kleine Carboxylsäuren fühlen sich eine große Affinität zu Wasser und polaren Lösungsmitteln. Wenn jedoch die Anzahl der Kohlenstoffatome größer als vier ist, überwiegt der hydrophobe Charakter der R -Ketten und wird mit Wasser nicht mischbar.
In fester oder flüssiger Phase spielen die Länge der R -Kette und die Substituenten, die sie besitzen. Wenn die Ketten sehr lang sind, interagieren sie durch die Londoner Dispersionskräfte wie im Fall von Fettsäuren miteinander.
Säure
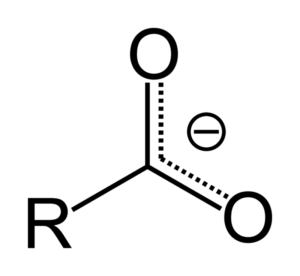
Wenn Carbonsäure ein Proton spendet, wird es zum Carboxylatanion, das im oberen Bild dargestellt wird. In diesem Anion wird die negative Belastung zwischen den beiden Kohlenstoffatomen verlegt, sie stabilisiert und daher die Reaktion zu bevorzugen.
Wie variiert diese Säure von einer Carbonsäure zur anderen? Es hängt alles von der Säure des Protons in der OH -Gruppe ab: Je ärmer in Elektronen, desto mehr Säure.
Diese Säure kann erhöht werden, wenn einer der RA -Kettensubstituenten eine elektronegative Spezies ist (die die elektronische Dichte aus ihrer Umgebung anzieht oder entzieht).
Zum Beispiel wenn in Cho3-COOH wird ein H der Methylgruppe durch ein Fluoratom (CFH) ersetzt2-COOH) Die Säure steigt erheblich an, da F die elektronische Dichte aus Carbonyl, Sauerstoff und dann Wasserstoff entzieht. Wenn alle h durch f (vgl. Ersetzt werden3-COOH) Säure erreicht ihren Maximalwert.
Kann Ihnen dienen: Wasserstoff: Geschichte, Struktur, Eigenschaften und VerwendungWelche Variable bestimmt den Säuregrad? Die PKZu. Je niedriger der PKZu Und näher an 1, größer ist die Fähigkeit der Säure, sich in Wasser zu dissoziieren und wiederum gefährlicher und schädlicher. Aus dem vorherigen Beispiel vgl. Vgl3-COOH hat den niedrigsten PK -WertZu.
Verwendet/Anwendungen von Carboxsäuren
Aufgrund der immensen Vielfalt von Carboxysäuren hat jeder von diesen eine potenzielle Anwendung in der Branche, sei es von Polymeren, Pharmazeutika oder Lebensmitteln.
Nahrungsmittelindustrie
- Additive.
- Konservierungsstoffe (Sorbinsäure und Benzoesäure).
- Alkalinitätsregler vieler Produkte.
- Produktion von Erfrischungsgetränken.
- Antimikrobielle Wirkstoffe vor der Wirkung von Antioxidantien. In diesem Fall ist der Trend flüssig antimikrobiell.
- Hauptbestandteil des gemeinsamen Essigs (Essigsäure).
- Säuremittel in kohlensäurehaltigen Getränken und Nahrung (Zitronensäure und Milchsäure).
- Assistent bei der Reifung von Schweizer Käse (Propionsäure).
- Käse, Chucrut, fermentiertes Colm und Erfrischungsgetränke (Milchsäure).
Pharmaindustrie
- Antipyrisch und analgetisch (Acetylsalicylsäure).
- Aktiv im Prozess der Aromasynthese, in einigen Arzneimitteln (Butyric oder Butansäure).
- Antimikotiker (Benzoesäure in Kombination mit Salicylsäure).
- Aktiv für die Herstellung von Vitamin C -Medikamenten (Ascorbinsäure).
- Fungizid (Caprilsäure).
- Herstellung einiger Abführmittel (Hydroxybothanodiumsäure).
Andere Branchen
- Herstellung von Kunststoffen und Schmierern (Sorbinsäure).
- Herstellung von Lacken, elastischen Harzen und transparenten Klebstoffen (Acrylsäure).
- Herstellung von Gemälden und Lack (Linolsäure).
- Herstellung von Seifen, Waschmitteln, Shampoos, Kosmetik und Metallreinigungsprodukten (Ölsäure).
- Zahnärztliche Pasta -Herstellung (Salicylsäure).
- Rayon -Acetatproduktion, fotografische Filme und Lösungsmittel für Farben (Essigsäure).
- Farbstoff- und gebräunte Produktion (Methansäure).
- Vorbereitung von Schmierölen, wasserdichten Materialien und Sekundenmalerei (Palmitinsäure).
- Gummiherstellung (Essigsäure).
- Gummiausarbeitung und Galvanoplastik.
- Lösungsmittel.
- Parfümproduktion (Benzoesäure).
- Herstellung von Weichmachern und Harzen (Photalsäure).
- Polyesterausarbeitung (Tereftallsäure).
- Herstellung von Paraffinkerzen (Stearinsäure).
Verweise
- Graham Solomons t.W., Craig b. Braten. Organische Chemie. Carboxylsäuren und deren Derivate (10. Ausgabe., Seite 779-783). Wiley Plus.
- Organische Säuren. Naturalwellbeing erholt sich.com
- Francis a. Schildpatt. Organische Chemie. Carbonsäuren. (Sechste Ausgabe., Seite 805-820). Mc Graw Hill.
- William Reusch. Carbonsäuren. Von der Chemie wiederhergestellt.MSU.Edu
- « Merkmale und Risikofaktoren der biologischen Vielfalt in Mexiko
- Die 5 Zweige der Hauptbiotechnologie »

