Molekulare Struktur Cyanhydsäure, Eigenschaften, verwendet

- 3952
- 1076
- Ivan Pressler
Er Hydrocyansäure o Wasserstoffcyanid ist eine organische Verbindung, deren chemische Formel HCN ist. Es ist auch als Metanonitril bekannt.
Cyanhydricsäure ist ein farbloses, extrem giftiges Gas, das bei der Behandlung von Cyaniden mit Säuren erhalten wird. Diese Säure befindet sich im penissten Samen, der an vielen Stellen auch als Pfirsich bekannt ist.
 Pfirsichsamen, der Wasserstoffcyanid oder Wasserstoff Cyanid, HCN enthält. Ein.Ha [cc by-sa 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons.
Pfirsichsamen, der Wasserstoffcyanid oder Wasserstoff Cyanid, HCN enthält. Ein.Ha [cc by-sa 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons. Bei einer Umgebungstemperatur von weniger als 25 ° C ist eine Flüssigkeit und über dieser Temperatur ist ein Gas. In beiden Fällen ist es für den Menschen, Tiere und sogar die Mehrheit der Mikroorganismen, die sich nicht an sie akklimatisiert haben, äußerst giftig. Es ist ein gutes Lösungsmittel für Ionen. Es ist sehr instabil, weil es dazu neigt, leicht zu polymerisieren.
Es kommt im pflanzlichen Königreich vor, das in die Moleküle einiger Glucoside eingebaut ist.
Diese Glucoside befinden sich in den Samen bestimmter Früchte wie Pfirsiche, Aprikose, Kirschen, Pflaumen und in bitteren Mandeln, sodass sie niemals aufgenommen werden sollten.
Es kommt auch in Pflanzen wie einigen Arten von Sorghum vor. Darüber hinaus produzieren einige Bakterien es während ihres Stoffwechsels. Es wird hauptsächlich in der Produktion von Polymeren und in einigen metallurgischen Prozessen verwendet.
HCN ist ein tödliches Gift aufgrund von Inhalation, Aufnahme und Kontakt. Es ist im Rauch der Zigarette und im Rauch des Feuers von Kunststoffen und Materialien vorhanden, die Kohlenstoff und Stickstoff enthalten. Es wird als Luftschadstoff angesehen, der während der Verbrennung von organischen Materialien aus umfangreichen Gebieten des Planeten auftritt.
[TOC]
Molekülstruktur und elektronische Konfiguration
Wasserstoffcyanid oder Cyanidsäure ist eine kovalente, molekulare Verbindung mit einem Wasserstoffatom, einem Kohlenstoff und einem von Stickstoff.
Das Kohlenstoff- und Stickstoffatom teilen 3 Elektronenpaare, sodass sie eine dreifache Verbindung bilden. Wasserstoff ist mit Kohlenstoff verbunden, was mit dieser Gewerkschaft seinen Valencia de Cuatro und seinen vollständigen Elektronen -Oktett präsentiert.
Der Stickstoff präsentiert eine fünf Valencia von fünf und um sein Oktett zu vervollständigen.
Das HCN ist daher ein völlig lineares Molekül, mit ein paar fehlenden Elektronen seitlich im Stickstoff.
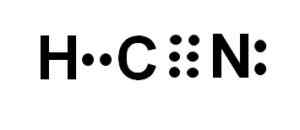 Lewis -Darstellung der Cyanhydsäure, wo die in jeder Bindung und das Paar einsamen Stickstoffelektronen geteilten Elektronen beobachtet werden. Autor: Marilú Stea.
Lewis -Darstellung der Cyanhydsäure, wo die in jeder Bindung und das Paar einsamen Stickstoffelektronen geteilten Elektronen beobachtet werden. Autor: Marilú Stea. 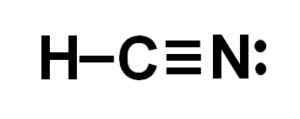 Wasserstoffcyanid- oder Wasserstoffcyanidstruktur, bei der die Dreifachbindung zwischen Kohlenstoff und Stickstoff beobachtet wird. Autor: Marilú Stea.
Wasserstoffcyanid- oder Wasserstoffcyanidstruktur, bei der die Dreifachbindung zwischen Kohlenstoff und Stickstoff beobachtet wird. Autor: Marilú Stea. Nomenklatur
- Hydrocyansäure
- Wasserstoffcyanid
- Metanonitril
- Formonitril
- Hydrocyansäure
Eigenschaften
Körperlicher Status
Unter 25,6 ° C ist es eine sehr instabile und giftige hellblaue Flüssigkeit oder blau, wenn es wasserfrei und stabilisiert ist. Wenn es darüber liegt, dass die Temperatur ein extrem giftiges farbloses Gas ist.
Molekulargewicht
27.03 g/mol
Schmelzpunkt
-13,28 ºC
Siedepunkt
25,63 ºC (Beachten Sie, dass es direkt über der Umgebungstemperatur kocht).
Flammpunkt
-18 ºC (Methode für geschlossene Tassen)
Selbststeuerungstemperatur
538 ºC
Kann Ihnen dienen: GaschromatographieDichte
0,6875 g/cm3 bei 20 ºC
Löslichkeit
Total mischbar mit Wasser, Ethylalkohol und Ethylether.
Dissoziationskonstante
K = 2,1 x 10-9
PkZu = 9.2 (es ist eine sehr schwache Säure)
Einige chemische Eigenschaften
Der HCN hat eine sehr hohe Dielektrizitätskonstante (107 bis 25 ° C). Dies liegt daran, dass ihre Moleküle sehr polar sind und durch Wasserstoffbrücken verbunden sind, wie im Fall von Wasser H2ENTWEDER.
Für eine so hohe Dielektrizitätskonstante ist HCN ein gutes ionisierendes Lösungsmittel.
Der flüssige wasserfreie HCN ist sehr instabil, es neigt dazu, heftig zu polymerisieren. Um dies zu vermeiden, werden Stabilisatoren als kleiner Prozentsatz von H hinzugefügt2SW4.
In wässriger Lösung und in Gegenwart von Ammoniak und Hochdruckadeninform, Verbindung, die Teil der DNA und RNA ist, dh ein biologisch wichtiges Molekül.
Es ist eine sehr schwache Säure, da seine Ionisierungskonstante sehr klein ist, so dass es nur teilweise im Wasser ist, was dem Cyanid -Anion CN vermittelt-. Formen Sie Salze mit den Basen, aber nicht mit Carbonaten.
Seine wässrigen Lösungen, die nicht vor Licht geschützt sind4.
In Lösung zeigt es einen schwachen Geruch von Mandeln.
Korrosivität
Da es sich um eine schwache Säure handelt, ist sie im Allgemeinen nicht korrosiv.
HCN wässrige Lösungen, die Schwefelsäure als Stabilisator enthalten.
Darüber hinaus können HCN -verdünnte wässrige Lösungen auch bei Raumtemperatur Kohlenstoffstahl verursachen.
Sie können auch einige Arten von Gummi, Kunststoffen und Beschichtungen angreifen.
Ort in der Natur
Es ist relativ reichlich im Pflanzenreich, Teil von Glucosides zu sein.
Zum Beispiel wird es aus dem Mandel C erzeugt C6H5-CH (-CN) -O-Glycose-Glycose, Verbindung in bitteren Mandeln vorhanden. Die Mandel ist ein cyanogenes Beta-Glucosid, denn beim hydrolysierten Hydrolyzieren bildet es zwei Glukosemoleküle, eines von Benzaldehyd und eines von HCN. Das Enzym, das sie freigibt, ist Beta-Glucoxidase.
Die Mandel ist in den Samen von Pfirsiche, Aprikosen, bitteren Mandeln, Kirschen und Pflaumen zu finden.
Einige Arten von Sorghumpflanzen enthalten die cyanogene Glucóside als Durrina (dh die P-Hydroxy- (S) -Mandelonitrilo-beta-d-glucosid). Diese Verbindung kann durch eine zweistufige enzymatische Hydrolyse abgebaut werden.
Erstens das Durrinosa-Enzym, das in Sorghumpflanzenhydrolys mit Glukose und P-Hydroxy- (p-hydroxy- (S) -Mandelonitrilo. Dann wird letzterer schnell frei HCN und P-Hydroxibenzaldehyd.
 Sorghumpflanze mit hohem Durrina -Gehalt. Kein maschinenlesbarer Autor zur Verfügung gestellt. Pethan nahm an (basierend auf Urheberrechtsansprüchen). [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikipedia Commons.
Sorghumpflanze mit hohem Durrina -Gehalt. Kein maschinenlesbarer Autor zur Verfügung gestellt. Pethan nahm an (basierend auf Urheberrechtsansprüchen). [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikipedia Commons. HCN ist verantwortlich für den Widerstand von Sorghumpflanzen gegenüber Schädlingen und Krankheitserregern.
Dies wird durch die Tatsache erklärt, dass das Durrina und das Durrinosa -Enzym in diesen Pflanzen unterschiedliche Orte haben und nur dann in Kontakt kommen, wenn das Gewebe verletzt oder zerstört wird, die HCN freigelassen und die Infektionsanlage schützt, die durch die verletzte Partei eindringen könnten.
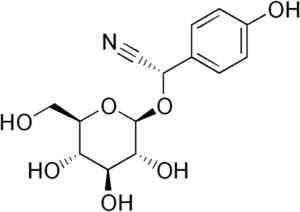 Durrina -Molekül, bei dem die dreifache CN -Bindung beobachtet wird, dass durch enzymatische Hydrolyse HCN produziert. Edgar181 [Public Domain]. Quelle: Wikipedia Commons.
Durrina -Molekül, bei dem die dreifache CN -Bindung beobachtet wird, dass durch enzymatische Hydrolyse HCN produziert. Edgar181 [Public Domain]. Quelle: Wikipedia Commons. Zusätzlich einige pathogene Bakterien des Menschen wie solche Pseudomonas aeruginosa Und P. Gingivalis Sie produzieren es während ihrer Stoffwechselaktivität.
Anwendungen
Bei der Herstellung anderer chemischer und Polymerenverbindungen
Die Verwendung, an der der größte Teil des auf industriellen Ebene produzierten HCN produziert wird, ist die Herstellung von Vermittlern für die organische Synthese.
Kann Ihnen dienen: Eisenoxid (ii): Struktur, Nomenklatur, Eigenschaften, verwendetEs wird in der Adiponitril-Synthese NC- (CH2)4-CN, mit dem Nylon oder Nylon hergestellt wird, ein Polyamid. Es dient auch dazu, Acrilonitrilo oder Cianoethylen Cho vorzubereiten2= CH-CN, verwendet zur Herstellung von Acryl- und Plastikfasern.
Sein Derivat -Natriumcyanid wird zur Wiederherstellung von Gold im Bergbau dieses Metalls verwendet.
Ein weiteres der Derivate CLCN Cyanogenchlorid dient für Pestizidformeln.
Der HCN wird zur Herstellung von Chelatmakdern wie EDTA (Ethylen-Diamino-Tetra-Acetato) verwendet.
Es dient zur Herstellung von Ferrocyaniden und einigen pharmazeutischen Produkten.
Verschiedene Verwendungen
HCN -Gas wurde als Insektizid, Fungizid und Desinfektionsmittel für Schiffs- und Gebäude -Begasung verwendet. Auch um Möbel zu rösten, um sie wiederherzustellen.
HCN wurde in Metallpolitur verwendet.
Für seine sehr hohe Toxizität wurde er zum chemischen Kriegsmittel ernannt.
In der Landwirtschaft
Es wurde als Herbizid und Pestizid in Obstgärten verwendet. Er hatte es verwendet, Skalen und andere Krankheitserreger von Zitrusbäumen zu kontrollieren, aber einige dieser Schädlinge sind gegen HCN resistent geworden.
Es wurde auch verwendet, um Getreidesilos zu rösten. Das auf der Baustelle vorbereitete gasförmige HCN wurde zur Begasung von Weizenkörnern verwendet, um sie vor Schädlingen wie Insekten, Pilzen und Nagetieren zu bewahren. Für diese Verwendung ist es wichtig, dass Samen dem Pestizidmittel vergrößert werden.
Mit HCN wurden Tests mit Weizensamen verblüfft, und es wurde festgestellt.
Hohe HCN -Dosen können jedoch die Länge kleiner Blätter, die aus dem Samen sprießen, erheblich verringern.
Andererseits wird das Potenzial von Sorghumpflanzen untersucht.
Seine Verwendung würde dazu dienen, Böden zu verbessern, Unkraut und Kontrollkrankheiten und Schäden durch phytoparasitische Nematoden zu unterdrücken.
Risiken
Für den Menschen ist HCN ein tödliches Gift auf allen Wegen: Inhalation, Aufnahme und Kontakt.
 Autor: Clker-Free-Vektor-Images. Quelle: Pixabay.
Autor: Clker-Free-Vektor-Images. Quelle: Pixabay. Inhaliert kann tödlich sein. Es wird geschätzt, dass etwa 60-70% der Bevölkerung den Geruch von bitteren HCN-Mandeln erkennen können.
Es gibt jedoch 20% der Bevölkerung, die sie noch nicht in tödlichen Konzentrationen erkennen können, weil sie genetisch nicht in der Lage sind, dies zu tun.
Aufgenommen ist ein akutes und sofortiges Handlungsgift.
Wenn Ihre Lösungen mit der Haut in Kontakt kommen, kann das assoziierte Cyanid tödlich sein.
Das HCN ist im Zigarettenrauch vorhanden und der erzeugt, der bei der Verbrennung von Kunststoffen erzeugt wird, die Stickstoff enthalten.
Tödlicher Wirkungsmechanismus im Organismus
Es ist eine Chemikalie und schnell giftig und führt häufig zum Tod. Beim Betreten des Organismus verbindet es die Metalloenzyme (Enzyme, die ein Metallion enthalten), die sie inaktivieren. Es ist ein giftiges Mittel für mehrere Organe des menschlichen Körpers
Seine toxische Hauptwirkung besteht in der Hemmung der zellulären Atmung, da es ein Enzym deaktiviert, das die Phosphorylierung in Mitochondrien beeinflusst, nämlich Organellen.
Kann Ihnen dienen: Kaliumpermanganat (kmno4)Zigarettenrauchrisiko
Der HCN ist im Zigarettenrauch vorhanden.
Obwohl viele Menschen die Wirkung der Vergiftung des HCN kennen, erkennen nur wenige Menschen, dass sie ihrer schädlichen Wirkung durch Zigarettenrauch ausgesetzt sind.
HCN ist eine der Ursachen für die Hemmung mehrerer Zell -Atemzyme. Die Menge an HCN im Zigarettenrauch hat eine schädliche Auswirkung auf das Nervensystem.
HCN -Spiegel wurden in Zigarettenrauch zwischen 10 und 400 μg pro Zigarette für den Rauch direkt und 0,006 bis 0,27 μg/Zigarette für die sekundäre Inhalation (passiver Raucher) berichtet. HCN erzeugt ab 40 μm toxische Wirkungen.
 Autor: Alexas Fotos. Quelle: Pixabay.
Autor: Alexas Fotos. Quelle: Pixabay. Schnell einatmen zu werden, tritt in den Blutkreislauf ein, wo er im Plasma freigesetzt wird oder an Hämoglobin bindet. Ein kleiner Teil wandelt sich in Tiocianato um und wird vom Urin ausgeschieden.
HCN -Heizungsrisiken
Eine längere Exposition gegenüber der Wärme des flüssigen HCN in geschlossenen Behältern kann gewalttätige und unerwartete Brechung von diesen verursachen. Es kann in Gegenwart von Alkalispuren und in Abwesenheit von Inhibitoren explosionsartig 50-60 ºC polymerisieren.
Vorhandensein von HCN im Feuerrauch
Das HCN wird während der Verbrennung von Polymeren freigesetzt, die Stickstoff wie Wolle, Seide, Polyacrylnitrilos und Nylon enthalten. Diese Materialien sind in unseren Häusern und an den meisten Stellen menschlicher Aktivitäten vorhanden.
Aus diesem Grund kann der HCN während der Brände möglicherweise die Todesursache durch Inhalation sein.
Atmosphäreschadstoff
HCN ist ein Troposphäreschadstoff. Es ist gegen Photólyse resistent und unter den Umweltbedingungen der Atmosphäre leistet keine Hydrolyse.
Oh Hydroxylradikale • Photochemisch erzeugt kann mit dem HCN reagieren, aber die Reaktion ist sehr langsam, so dass das halbe Leben der HCN in der Atmosphäre 2 Jahre beträgt.
Wenn Biomasse brennt, insbesondere Mob, wird HCN in die Atmosphäre und auch während der industriellen Aktivitäten freigesetzt. Die Verbrennung von Torf ist jedoch 5- bis 10 -mal mehr verschmutzt als das Verbrennen anderer Biomassetypen.
Einige Forscher haben herausgefunden, dass hohe Temperaturen und Dürre durch das El Niño -Phänomen in bestimmten Bereichen des Planeten verursacht werden.
 Autor: Steve Buissinne. Quelle: Pixabay.
Autor: Steve Buissinne. Quelle: Pixabay. Dies führt zu einer intensiven Verbrennung von Biomasse in Trockenstationen.
Diese Ereignisse sind die Quelle für hohe HCN -Konzentrationen in der Troposphäre, die schließlich in die niedrige Stratosphäre transportiert werden, und bleibt sehr lange verbleiben.
Verweise
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- ODER.S. Nationalbibliothek für Medizin. (2019). Wasserstoffcyanid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Gidlow, d. (2017). Wasserstoff Cyanid-an Update. Berufsmedizin 2017; 67: 662-663. NCBI erholte sich.NLM.NIH.Regierung.
- Van Nostrands wissenschaftliche Enzyklopädie. (2005). Wasserstoffcyanid. 9th Aus der Online -Bibliothek abgerufen.Wiley.com.
- Ren und.-L. et al. (neunzehn sechsundneunzig). Wirkung von Wasserstoff Cyanid und Carbonylsulfid auf die Keimung und die Pfltrumuluskraft von Weizen. Pestisch. Sci. 1996, 47, 1-5. Aus der Online -Bibliothek abgerufen.Wiley.com.
- Von Nicola, G.R. et al. (2011). Zu einer einfachen Analysemethode zur Bewertung des Dhurringehalts in cyanogenen Pflanzen für ihre Verwendung bei Futter und Biofumation. J. Landwirtschaftlich. Food Chem. 2011, 59, 8065-8069. Aus Pubs geborgen.ACS.Org.
- Schäle, p.UND. et al. (2017). Eine globale Verbesserung des Wasserstoffcyanids in der unteren Stratosphäre von 2016. Geophys. Rindfleisch. Lette., 44, 5791-5797. Von Agupubs geborgen.Online -Bibliothek.Wiley.com.
- Surleva, a.R. und drochioiu, g. (2013). Visualisierung Rauchgefahr: Einfache spektrophotometrische Bestimmung von Wasserstoffcyanid in Zigarettenrauch und Filtern. J. Chem. Bildung. 2013, 90, 1654-1657. Aus Pubs geborgen.ACS.Org.
- Alarie und. et al. (1990). Rolle von Wasserstoff Cyanid bei den Todesfällen beim Menschen beim Feuer. In Feuer und Polymeren. Kapitel 3. ACS -Symposiumserie. Aus Pubs geborgen.ACS.Org.
- « Chromsäurstruktur, Eigenschaften, erhalten, verwendet, verwendet
- 8 Experimente mit sehr kontroversen Menschen »

