Chromsäurstruktur, Eigenschaften, erhalten, verwendet, verwendet

- 2966
- 889
- Nick Laurén
Er Chromsäure oder h2Cro4 Die mit Chromoxid (VI) oder CRO Cromicoxid assoziierte Säure ist theoretisch3. Diese Konfession ist auf die Tatsache zurückzuführen, dass in den sauren wässrigen Lösungen des Chromoxids die Spezies h2Cro4 Es ist mit anderen Chromarten (VI) vorhanden.
Cromicoxid3 Es wird auch als wasserfreies Chromsäure bezeichnet. Der Cro3 Es handelt2Cr2ENTWEDER7 Mit Schwefelsäure H2SW4.
 Cromic Oxid zerkleinert3 In einem Schmelztiegel. Rando Tuiken [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons.
Cromic Oxid zerkleinert3 In einem Schmelztiegel. Rando Tuiken [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons. Wässrige Chromoxidlösungen haben ein Gleichgewicht bestimmter chemischer Spezies, deren Konzentration vom pH -Wert der Lösung abhängt. Basis -pH -PH -Prädiominat Cromat Ions CRO42-, Während HCRO -Säureionen vorherrschen4- und Cr dicromato2ENTWEDER72-. Es wird geschätzt, dass Säuresäure auch Chromsäure H aufweist2Cro4.
Aufgrund seiner großen Oxidationskraft werden Chromsäurelösungen in der organischen Chemie verwendet, um Oxidationsreaktionen durchzuführen. Sie werden auch in elektrochemischen Prozessen zur Behandlung von Metallen verwendet, damit sie Resistenz gegen Korrosion und Verschleiß erlangen.
Bestimmte polymere Materialien werden auch mit Chromsäure behandelt, um ihre Adhäsion an Metallen, Gemälden und anderen Substanzen zu verbessern.
Chromsäurelösungen sind sowohl für Menschen als auch für die meisten Tiere und die Umwelt sehr gefährlich. Aus diesem Grund werden die flüssigen oder festen Prozesse Abfälle, bei denen Chromsäure verwendet wird.
[TOC]
Struktur
Das Chromsäuremolekül H2Cro4 Es wird durch ein Cromato -Cro -Ion gebildet42- und zwei Wasserstoffionen H+ Damit vereint. Im Chromation Ion befindet sich das Chromelement in einem Oxidationszustand von +6.
Die räumliche Struktur des Chromations ist Tetraeder, wo sich Chrom in der Mitte befindet und Sauerstoff die vier Eckpunkte des Tetraeders belegen.
In Chromsäure -Wasserstoffatomen befinden sich jeweils neben einem Sauerstoff. Von den vier Chrombindungen mit den Sauerstoffatomen sind zwei doppelt und zwei einfach, da sie die Hydringen mit ihnen vereint haben.
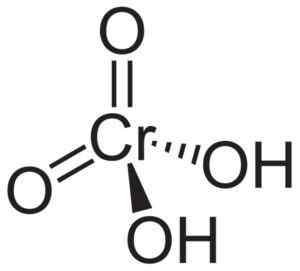 Chromsäurstruktur H2Cro4 wo die tetraedrische Form des Chromats und ihre Doppelbindungen beobachtet werden. Neuroteker [Public Domain]. Quelle: Wikipedia Commons.
Chromsäurstruktur H2Cro4 wo die tetraedrische Form des Chromats und ihre Doppelbindungen beobachtet werden. Neuroteker [Public Domain]. Quelle: Wikipedia Commons. Andererseits Cro -Croomic -Oxid3 Es hat ein Oxidationschromatom +6, das von nur drei Sauerstoffatomen umgeben ist.
Nomenklatur
- Cromensäure h2Cro4
- Tetraoxochromensäure h2Cro4
- Cromicoxid (wasserfreier Chromsäure) CRO3
- Chrom -Trioxid (wasserfreier Chromsäure) CRO3
Eigenschaften
Körperlicher Status
Anhydro- oder Chromoxidchromsäure ist ein kristalliner Feststoff von lila bis rot
Molekulargewicht
Cro3: 118.01 g/mol
Schmelzpunkt
Cro3: 196 ºC
Über seinem Schmelzpunkt ist thermisch instabil, es verliert Sauerstoff (er wird reduziert), um Chromoxid (III) CR zu ergeben2ENTWEDER3. Es zersetzt sich bei ungefähr 250 ° C.
Dichte
Cro3: 1,67-2,82 g/cm3
Löslichkeit
Der Cro3 Es ist sehr löslich in Wasser: 169 g/100 g Wasser bei 25 ° C.
Es ist löslich in Mineralsäuren wie Schwefel und Stillschicht. Alkohollöslich.
Andere Eigenschaften
Der Cro3 Es ist sehr hygroskopisch, seine Kristalle sind köstlich.
Wenn der Cro3 Es löst sich in Wasser auf, die stark saure Lösungen bilden.
Kann Ihnen dienen: Titan: Geschichte, Struktur, Eigenschaften, Reaktionen, verwendetEs ist ein sehr starkes Oxidationsmittel. Oxy in fast all seinen Formen kräftig organischer Substanz. Greift den Stoff, das Leder und einige Kunststoffe an. Die meisten Metalle greifen auch an.
Es ist stark giftig und sehr irritierend aufgrund seines hohen Oxidationspotentials.
Chemie wässriger Lösungen, bei denen Chromsäure vorhanden ist
Cromicoxid3 Es löst sich schnell im Wasser auf. In wässrigen Lösung Chrom (VI) kann in verschiedenen ionischen Formen existieren.
Ein Ph> 6,5 oder in alkalischer Lösungchrom (VI) erhält die Cromato -Ionenform42- Gelb.
Wenn der pH -Wert verringert ist (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , die zu Ion Dicromato Cr dimerisieren können2ENTWEDER72-, Und die Lösung wird orange. Bei pH zwischen 2,5 und 5,5 sind die vorherrschenden Spezies HCRO4- und Cr2ENTWEDER72-.
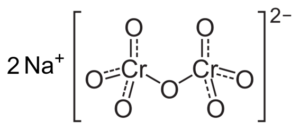 Kriminalionionenstruktur2ENTWEDER72- Das ist neben zwei Natriumna -Ionen+. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons.
Kriminalionionenstruktur2ENTWEDER72- Das ist neben zwei Natriumna -Ionen+. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons. Die in diesen Lösungen auftreten, wenn der pH -Wert untergeht, sind die folgenden:
Cro42- (Chromation) + h+ ⇔ hcro4-
HCRO4- + H+ ⇔ h2Cro4 (Chromsäure)
2HCRO4- ⇔ Cr2ENTWEDER72- (Dicromation) + H2ENTWEDER
Diese Guthaben treten nur dann auf, wenn die Säure, die zugesetzt wird, um den pH -Wert zu senken3 oder HCLO4, Weil mit anderen Säuren verschiedene Verbindungen gebildet werden.
Die sauren Lösungen von Dichromat sind sehr energetische Oxidationsmittel. Aber in alkalischen Lösungen ist das Chromation viel weniger oxidationsmäßig.
Erhalten
Nach den konsultierten Quellen ist eine Möglichkeit, das CRO -Cromicoxid zu erhalten3, Dies besteht darin, Schwefelsäure zu einer wässrigen Lösung von Natrium- oder Kaliumdichromat hinzuzufügen und einen rot-orangefarbenen Niederschlag zu bilden.
 Cromicoxid hydratisiert oder Chromsäure. Himstakan [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons.
Cromicoxid hydratisiert oder Chromsäure. Himstakan [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons. Cromensäure h2Cro4 Es kommt in wässrigen Chromoxidlösungen in saurem Medium vor.
Chromsäure verwendet
In der Oxidation chemischer Verbindungen
Aufgrund seiner stark oxidierenden Kapazität wurde Chromsäure seit langem und erfolgreich zum Oxidieren von organischen und anorganischen Verbindungen verwendet.
Unter den unzähligen Beispielen befinden sich Folgendes: Es ermöglicht die oxidierende oxidierende primäre Alkohole zu Aldehydos und diese an Carboxylsäuren, Alkohole, die sekundär zu Ketonen, Toluol an Benzoesäure, Ethylbenzol an Acetophenon, Triflenylmetano zu Tifenylcarbinol, Formic Säure a co -Coco2, Oxalsäure an co2, Milchsäure zu Acetaldehyd und CO2, Eisen Glaube2+ Ein Eisenglauben Glaubensgläubiger3+, Ionenjodid zu Jod usw.
Ermöglicht die Umwandlung von Lachkritiken in Nitro-Kompounds, Sulfide in Sulfone. Es interveniert in die Synthese von Ketonen, die auf Alkenen basieren, wie die hydroborierten Alkene zu Ketonen oxidierten.
Verbindungen, die sehr resistent gegen übliche Oxidationsmittel wie Sauerstoff oder2 oder Wasserstoffperoxid H2ENTWEDER2, Sie werden durch Chromsäure oxidiert. Dies ist der Fall bestimmter heterocyclischer Bastessen.
In Metallanodisierungsprozessen
Chromsäure -Anodisierung ist eine elektrochemische Behandlung, die für Aluminium anwendbar ist, um sie viele Jahre vor Oxidation, Korrosion und Verschleiß zu schützen.
Der Anodisierungsprozess beinhaltet die elektrochemische Bildung einer Schicht aus Aluminiumoxid oder Aluminiumoxid auf Metall. Diese Schicht wird dann in heißem Wasser versiegelt, was durch Umwandlung in trihydratisiertes Aluminiumoxid erreicht wird.
Die versiegelte Oxidschicht ist dick, aber strukturell schwach und für nachfolgende Klebergewerkschaften nicht sehr zufriedenstellend. Indem jedoch eine kleine Menge Chromsäure zum Versiegelungswasser hinzugefügt wird, wird eine Oberfläche entwickelt, die gute Bindungen bilden kann.
Kann Ihnen dienen: Gesetz über die Erhaltung der MaterieChromsäure im Dichtungswasser löst einen Teil der Zellstruktur vom dicken Zell und hinterlässt eine dünne, starke, fest an Aluminiumoxid befestigt.
Die Anodierung mit Chromsäure gilt auch für Titan und seine Legierungen.
Bei chemischen Umwandlungsbehandlungen
Chromsäure wird in Metallbeschichtungsprozessen durch chemische Umwandlung verwendet.
Während dieses Prozesses werden Metalle in Chrominsäurelösungen getaucht. Dies reagiert und löst teilweise die Oberfläche ab, die gleichzeitig eine dünne Schicht komplexer Chromverbindungen abhebt, die mit dem Grundmetall interagieren.
Dieser Prozess wird als Chromat -Umwandlungsbeschichtung oder Umwandlungschrom bezeichnet.
Die Metalle, die im Allgemeinen einem Umwandlungschrom ausgesetzt sind Mangan und Silber.
Diese Behandlung bietet Korrosion und Helligkeitsresistenz gegen Metall. Ein höherer pH -Wert des Prozesses größerer Widerstand gegen Korrosion. Die Temperatur beschleunigt die Säurereaktion.
Die Beschichtung verschiedener Farben kann angewendet werden, wie Blau, Schwarz, Gold, Gelb und transparent. Es bietet auch eine bessere Annahme der Metalloberfläche gegenüber Gemälden und Klebstoffen.
In erodierter oder gehackter Oberfläche
Chromsäurelösungen werden zur Herstellung der Oberfläche von thermoplastischem Material, thermosystemischen Polymeren und Elastomeren für die spätere Beschichtung mit Gemälden oder Klebstoffen verwendet.
Die h2Cro4 Erreicht einen Einfluss auf die Oberflächenchemie und ihre Struktur, da es dazu beiträgt, seine Rauheit zu erhöhen. Die Kombination von Bissen und Oxidation erhöht die Durchdringung von Klebstoffen und kann sogar Veränderungen der Polymereigenschaften verursachen.
Es wurde verwendet, um verzweigtes Polyethylen aus niedriger Dichte, hoher Dichte und Polypropylen linearem Polyethylen zu erodieren.
Es wird in der Electro-Receipt- oder Galvanoplastikindustrie häufig verwendet, um die Metallpolymeradhäsion zu erleichtern.
In mehreren Verwendungen
Chromsäure wird als Holzkonservierungsmittel verwendet, auch in magnetischen Materialien und zur Katalyse der chemischen Reaktionen.
Cromensäurewiederherstellung
Es gibt viele Prozesse, die Chromsäure verwenden und Ströme oder Reste erzeugen, die Chrom (III) enthalten, die nicht verworfen werden können.
Seine Disposition erfordert die chemische Reduktion von Chromaten gegenüber Chrom (III), gefolgt von Hydroxid- und Filtrationsniederschlag, was zusätzliche Kosten erzeugt.
Aus diesem Grund wurden verschiedene Methoden untersucht, um Chromate zu entfernen und wiederherzustellen. Hier sind einige davon.
Durch die Verwendung von Harzen
Seit vielen Jahren werden Ionenaustauschharze für chromatisch kontaminierte Wasserbehandlung verwendet. Dies ist eine der Behandlungen, die von der US -amerikanischen Umweltschutzbehörde oder der EPA (Akronym für Englisch Umweltschutzbehörde).
Diese Methode ermöglicht die Wiederherstellung konzentrierter Chromsäure, da sie erneut aus dem Harz regeneriert wird.
Harze können stark oder schwach sein. In stark grundlegenden Harzen kann das Chromat als HCRO -Ionen entfernt werden4- und Cr2ENTWEDER72- Sie werden mit OH -Ionen ausgetauscht- und Cl-. In schwach grundlegenden Harzen, zum Beispiel Sulfat, werden Ionen mit SOS ausgetauscht42-.
Kann Ihnen dienen: NepelometrieBei stark grundlegenden Harzen R- (OH) sind globale Reaktionen wie folgt:
2RoH + HCRO4- + H+ ⇔ r2Cro4 + 2H2ENTWEDER
R2Cro4 + 2HCRO4- ⇔ 2RHCRO4 + Cro42-
R2Cro4 + HCRO4- + H+ ⇔ r2Cr2ENTWEDER7 + H2ENTWEDER
Für jeden Mol von r2Cro4 Das Umwandeln eines Mol Cr (VI) der Lösung wird entfernt, was diese Methode sehr attraktiv macht.
Nach der Entfernung der Chromate wird das Harz mit einer stark alkalischen Lösung behandelt, um sie an einem sicheren Ort zu regenerieren. Dann werden die Chromate in konzentrierte Chromsäure umgewandelt, um wiederverwendet zu werden.
Durch elektrochemische Regeneration
Eine andere Methode ist die elektrochemische Regeneration von Chromsäure, die auch eine sehr bequeme Alternative ist. Durch dieses Verfahren ist Chrom (III) oxidal zu Chrom (VI) oxidiert oxidiert. Das Anodenmaterial in diesen Fällen ist vorzugsweise Bleidioxid.
Verwendung von Mikroorganismen zur Bereinigung von Abwässern mit Chromsäureresten
Eine Methode, die untersucht wurde und noch untersucht wird.
 Schädliche Abwässer für die Umwelt. Autor: OpenClipart-Vektoren. Quelle: Pixabay.
Schädliche Abwässer für die Umwelt. Autor: OpenClipart-Vektoren. Quelle: Pixabay. Dies ist der Fall bei bestimmten Bakterien, die im Bräunungsabwassergewässer vorhanden sind. Diese Mikroben wurden untersucht und festgestellt, dass sie gegen Chromate resistent sind und auch Chrom (VI) auf Chrom (III) reduzieren können, was für die Umwelt und Lebewesen viel weniger schädlich ist.
Aus diesem Grund wird geschätzt, dass sie als umweltfreundliche Methode für die Sanierung und Entgiftung von mit Chromsäurwellen kontaminierten Abwässer verwendet werden können.
Chromsäurerisiken und Chromoxid
Der Cro3 Es ist kein Kraftstoff, sondern kann die Verbrennung anderer Substanzen intensivieren. Viele Ihrer Reaktionen können Feuer oder Explosion verursachen.
Der Cro3 und Chromsäurlösungen sind starke reizende Haut (sie können Dermatitis verursachen), Augen (können sie verbrennen) und Schleimhautmembranen (können Bronchasma verursachen) und können die sogenannten "Chrom -Hohls" im Atmungssystem verursachen.
Chromverbindungen (VI) wie Chromsäure und Chromoxid sind für die meisten Lebewesen stark toxisch, mutagen und krebserregend.
Verweise
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- ODER.S. Nationalbibliothek für Medizin. (2019). Chromsäure. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Wegman, r.F. und Van Twisk, j. (2013). Aluminium- und Aluminiumlegierungen. 2.5. Chromsäure -Anodisierungsprozess. In Oberflächenvorbereitungstechniken für die Kleberbindung (zweite Ausgabe). Von Scientedirect erholt.com.
- Wegman, r.F. und Van Twisk, j. (2013). Magnesium. 6.4. Herstellung von Magnesium- und Magnesiumlegierungen durch die Chromsäurebehandlungsprozesse. In Oberflächenvorbereitungstechniken für die Kleberbindung (zweite Ausgabe). Von Scientedirect erholt.com.
- Grot, w. (2011). Anwendungen. 5.1.8. Chromsäureregeneration. In fluorierten Ionomeren (zweite Ausgabe). Von Scientedirect erholt.com.
- Swift, k.G. und Booker, J.D. (2013). Oberflächen -Engineering -Prozess. 9.7. Verchromatisch. Im Herstellungsprozessauswahlhandbuch. Von Scientedirect erholt.com.
- Poulson, a.H.C. et al. (2019). Oberflächenmodifikationstechniken von Peek, einschließlich Plasmaoberflächenbehandlung. elf.3.2.1. Oberflächenätzung. In Peek Biomaterials Handbook (zweite Ausgabe). Von Scientedirect erholt.com.
- Westheimer, f.H. (1949). Die Mechanismen von Chromsäuroxidationen. Chemische Rezensionen 1949, 45, 3, 419-451. Aus Pubs geborgen.ACS.Org.
- Tan, h.K.S. (1999). Chromsäure Remival durch Anionenaustausch. The Canadian Journal of Chemical Engineering, Band 77, Februar 1999. Aus der Online -Bibliothek abgerufen.Wiley.com.
- Kabir, m.M. et al. (2018). Isolierung und Charakterung von Chrom (VI) -reduzierenden Bakterien aus Gerbereiabwässern und festen Abfällen. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI erholte sich.NLM.NIH.Regierung.
- « Industrielandschaftsmerkmale, Elemente und Beispiele
- Molekulare Struktur Cyanhydsäure, Eigenschaften, verwendet »

