Schwache Säure
- 4787
- 412
- Lewis Holzner
 Schwache Säure -Beispiele
Schwache Säure -Beispiele Was ist eine schwache Säure?
Eine schwache Säure ist eine, die in wässriger Lösung wenig in Wasserstoff (h+) und in seiner entsprechenden konjugierten Basis. Im Gegensatz zu starken Säuren, deren Dissoziation vollständig ist (100%) und praktisch irreversibel, sind schwache Säuren kaum dissoziiert und reversibel.
Daher erzeugt eine schwache Säure weniger Ehrungen H+ In Wasser dessen, was zu erwarten wäre. Unter den repräsentativsten schwachen Säuren haben wir Essigsäure, die Hauptkomponente von Essig, die ungefähr in einem 0 liegt.5 % unter normalen Bedingungen.
Dies bedeutet, dass der größte Anteil einer Essigsäurelösung in Wasser, wie beispielsweise 5%Kochessig, in nicht identischer Form ist (CH3Cooh); Während ein kleiner Teil als konjugierte Basis gefunden wird (wählen Sie3Gurren-), begleitet von Hionen+, oder genauer gesagt, h Ionen3ENTWEDER+.
Da die Menge an Wasserstoff, die durch eine schwache Säure in wässriger Lösung freigesetzt wird. Zum Beispiel hat Essig einen pH -Wert von 2.5, Orangensaft pH 3.3. 4.2 und der 2 Zitronensaft von 2.
Diese pH -Wert sind zwar sauer, sind jedoch höher als der pH -Wert, der eine Lösung einer starken Säure erzeugt (HCl, H2SW4, usw.) dass sie den Wert von 1 oder weniger erreichen können (negative pH -Werte).
Eigenschaften schwacher Säuren
pH -Wert Ihrer Lösungen
Schwache Säuren haben normalerweise einen pH -Wert zwischen 2.0 und weniger als 7.0, also drehen sie die Farbe des Pannasolpapiers rot. Diese pH -Werte sind viele höher als die pH -Werte, die durch starke Säuren erzeugt werden, obwohl es Ausnahmen gibt.
Beispielsweise hat eine 1 mM Salzsäurelösung (eine starke Säure) einen pH -Wert von 3.0, während eine 1 mm -Lösung von Fluorhorsäure (eine "schwache" Säure) einen pH von 3 hat.2, der nahe an der von starker Säure liegt.
Teilionisation
Schwache Säuren in Lösung sind nur wenig oder teilweise in Wasser ionisiert und dissoziieren in der konjugierten Basis von Säure und Wasserstoffionen. Dann wird eine schwache Säure in wässriger Lösung größtenteils dissoziiert, mit einem kleinen dissoziierten Anteil.
Kann Ihnen dienen: Balancing chemischer GleichungenWenn die von einer schwache Säure in Wasser freigesetzte Wasserstoffmenge niedrig ist, ist der von dieser Säure erzeugte pH -Wert höher als der durch eine stark in Wasser gelöste starke Säure.
Reversible Ionisation
Die Ionisierung einer schwachen Säure wird normalerweise wie folgt schematisiert:
Hat ⇌ a- + H3ENTWEDER-
Wo gibt es schwache Säure, um- seine konjugierte Basis und h3ENTWEDER+ Das Hydroniumkation, das in H der Weg ist+ Es existiert oder manifestiert sich im Wasser. Die Konzentration (oder Aktivität) von h3ENTWEDER+ Es wird anstelle von h verwendet+ Zur Bestimmung der Lösung der Lösung.
Ionisationsgrad
Einige Säuren sind schwächer als andere, was zu sagen ist, sie sind weniger ionisiert. Daher ermöglicht uns der Ionisationsgrad, wie saure eine Säure unter bestimmten Bedingungen ist.
Um den Grad der Ionisation auszudrücken, wurden mehrere Parameter eingeführt, wie die Ionisation oder Säurekonstante (KA) und die PKA: eine Möglichkeit, KA in einer einfachen Zahl auszudrücken, die die Verwendung einer in negativen Kräfte ausgedrückten Zahl von zehn ausgelassen hat (10 ), wie es im KA existiert.
KA- und PKA -Konstanten werden hauptsächlich für schwache Säuren verwendet.
Ka = [a-] [H+] / [Ha]
Die in der Formel vorhandenen Klammern repräsentieren Konzentrationen.
pka = - log ka
Der PKA -Wert einer schwachen Säure liegt normalerweise zwischen 2 und 12. Aber es gibt Ausnahmen. Zum Beispiel: und und odagische Säure (HIO3) hat eine PKA von 0.77, der als relativ kleiner Wert angesehen wird, aber ohne negativ zu sein, für eine schwache Säure in einem strengen Sinne.
Konjugat -Basisstabilität
Schwache Säuren haben eine starke Bindung mit saurem Wasserstoffatom (H)δ+-Xδ-), so dass sie einen geringen Grad an Wasserstoff dissoziation. Dies führt zur konjugierten Basis von schwacher Säure hat eine große Avidität durch Wasserstoff, die eine starke konjugierte Base ist.
Kann Ihnen dienen: KolloidDas heißt, die konjugierte Basis einer schwachen Säure ist sehr instabil, weil sie H akzeptiert+ sehr leicht zurückgegeben. Je instabiler diese konjugierte Base, desto schwächer wird die Säure in Frage.
Niedrige ionische Leitfähigkeit
Schwache Säuren sind wenig ionisiert, sind schlechte Stromleiter, im Gegensatz zu starken Säuren, die gute Elektrizitätsleiter sind.
Präsenz in der Natur
Schwache Säuren sind in der Natur weit verbreitet, zum Beispiel sind sie in Zitrusfrüchten (Zitrone, Grapefruit, Orange usw.).
Sie sind auch in zahlreichen Prozessen vorhanden, die in allen Lebewesen auftreten. Einige dieser biologischen schwachen Säuren sind pyruvisch, laktisch, zitronisch, fumarisch, succinical, glutamisch usw., Und selbst sauerstoffhaltiger Hämoglobin setzt Wasserstoff frei, so dass es sich wie eine schwache Säure verhält.
Dann kann der Schluss gezogen werden, dass der Mensch in dauerhaftem Kontakt mit schwachen Säuren lebt.
Wie man den pH -Wert einer schwachen Säure berechnet?
Der pH-Wert einer schwachen Säure kann unter Verwendung der Säurekonstante (KA) oder der Henderson-Haselbalch-Gleichung berechnet werden. Im ersten Beispiel wird Ka verwendet.
Mit Säurekonstante
Berechnen Sie den pH -Wert einer Lösung 0.5 m Benzoesäure (C. C6H5Cooh), der eine Ionisationskonstante (ka) = 1 hat.8 x 10-5
C6H5Cooh ⇌ c6H5Gurren- + H+ (1)
Wenn die Menge an Säure, die dissoziiert, X wird, dann 0.5 m-x ist die Konzentration von schwacher Säure, die im Gleichgewicht nicht dissoziiert ist und die Konzentration der Konjugatbase von Benzoesäure und Wasserstoffionenkonzentration ist.
Gleichung (1) kann wie folgt dargestellt werden:
0.5 m-x ⇌ x +x
Schwache Säuren sind in einem sehr geringen Verhältnis ionisiert, so dass die Konzentration von Benzoesäure im Gleichgewicht von (0.5 m-x) kann als 0 angenommen werden.5 m, seit x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Deshalb [h+] ist gleich 3 x 10-3 M. Wir lösen dann, indem wir den pH -Wert berechnen:
Es kann Ihnen dienen: MoHR -Methode: Grundlagen, Reaktionen, Verfahren, verwendetPH = - log [h+]
= - log [3 x 10-3]
pH = 2.52
Beachten Sie, dass der pH -Wert relativ sauer ist, da er sich unter 3 oder 4 befindet.
Mit Henderson-Haselbalch-Gleichung
Die Henderson-Haselbalch-Gleichung wird verwendet, um den pH-Wert einer Pufferlösung zu berechnen:
PH = PKA + log [konjugierte Base] / [Säure]
Beispiel:
Natriumhydroxid (NaOH) wird zu einer Essigsäurelösung zugesetzt, die eine Endkonzentration von Essigsäure erzeugt (CH3Cooh) 1.11 x 10-2 mol/l und eine konjugierte Basenkonzentration (wählen3Gurren-) von 0.44 x 10-2 mol/l. Wenn es mit Essigsäure PKA 4 beträgt.75 Berechnen Sie den pH -Wert der Lösung.
PH = 4.75 +log [a-] / [Ha]
PH = 4.75 +log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
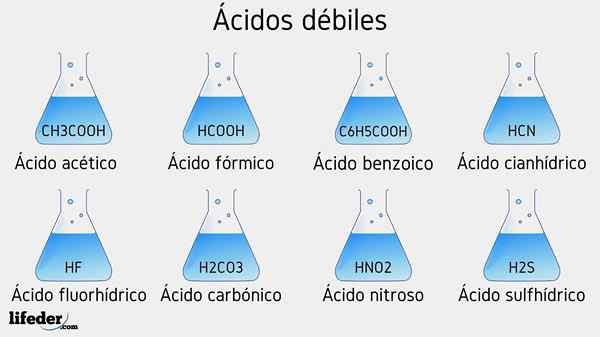
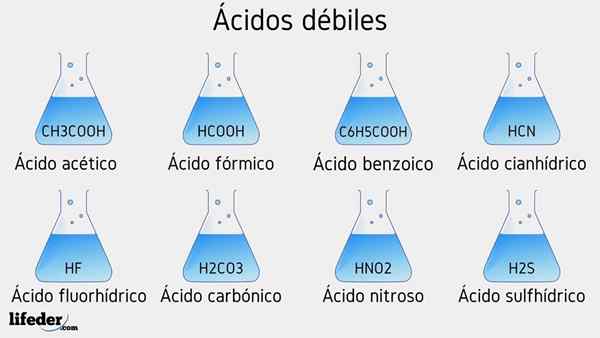
Schwache Säure -Beispiele
Im Folgenden werden mehrere schwache Säuren begleitet, die von ihren PKA -Werten begleitet werden:
- CH3COOH (Essigsäure), PKA 4.75
- HCOOH (Ameisensäure), PKA 3.74
- C6H5COOH (Benzoesäure), PKA 5.59
- CH2ClCOOH (Chloressigsäure), PKA 2.85
- HCN (Cyanhydsäure), PKA 9.31
- Hf.17
- C2H5COOH (Propionsäure), PKA 4.89
- Hno2 (Lessungsteuer), PKA 3.35
- H2S (Sulfidsäure), PKA1 6.0 und PKA2 12.92
- CCL3COOH (Trichloressigsäure), PKA 0.52
- H2CO3 (Kohlensäure), PKA1 6.37 und PKA2 10.22
- H3Po4 (Phosphorsäure), PKA1 2.12, PKA2 4.21 und PKA3 elf.0
- C6H5SW3H (Benzefonsäure), PKA 0.70
- HIO3 (Yodiumsäure), PKA 0.77
- HCLO2 (Chlorsäure), PKA 2.0
- CH3CH2(OH) COOH (Milchsäure), PKA 3.08
Schwache Säuren mit therapeutischen Anwendungen
- Salicylsäure, PKA 3.00
- Acetylsalicylsäure, PKA 3.49
- Furosemid, PKA 3.90
- Ibuprofen, PKA 4.40
- Levodopa, PKA 2.30
- Phenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Morris, j. G. (1974). Physikochemie für Biologen. (2. Aufl.). Ich kehrte um.
- Helmestine, Anne Marie, ph.D. (29. August 2020). Schwache Säuredefinition und Beispiel in der Chemie. Erholt von: thoughtco.com
- Ophardt c., & McCarthy l. (15. August 2020). Säure- und Basenfestigkeit. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Clark Jim. (2013). Starke und schwache Säure. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Lumenlernen. (S.F.). Chemie für Nicht-Majors: Berechnung des pH-Werts von schwachen Säure- und Basenlösungen. Erholt von: Kurse.Lumenarning.com

