Was ist disulfurisch Was ist Struktur, Eigenschaften, verwendet
- 2848
- 438
- Medine Kedzierski
Was ist Disulfursäure?
Er Disulfursäure Es ist eine der vielen Schwefeloxoäakids, deren chemische Formel H ist2S2ENTWEDER7. Die Formel zeigt ausdrücklich an, dass es zwei Schwefelatome gibt, und wie der Name auch betont, müssen es zwei H -Moleküle geben2SW4 einziger; Es gibt jedoch sieben Sauerstoff anstelle von acht, daher muss ein Schwefel drei haben.
Diese Säure ist eine der Hauptbestandteile des Öls (oder Rauchschwefelsäure), die zu einer "dichten" Form der Schwefelsäure wird. Dies ist ihre Vorherrschaft, die einige Öl als Synonym für Disulfursäure betrachten. Das ist auch unter dem traditionellen Namen der Pyrosulfursäure bekannt.
Im Bild wird ein Empfänger mit Öl mit einer Konzentration von Schwefeltrioxid gezeigt3, 20 %. Diese Substanz ist dadurch gekennzeichnet, dass sie ölig und farblos sind; Obwohl gelblich oder braun gelb werden kann, abhängig von der Konzentration des SO3 und der Anwesenheit einiger Verunreinigungen.
Die oben genannten erzählt die Teilnahme des SO3 in h2S2ENTWEDER7; das heißt ein H -Molekül2SW4 Reagieren mit einem von so3 Disulfursäure bilden. Dann sein, h2S2ENTWEDER7 Es kann auch als h geschrieben werden2SW4· SW3.
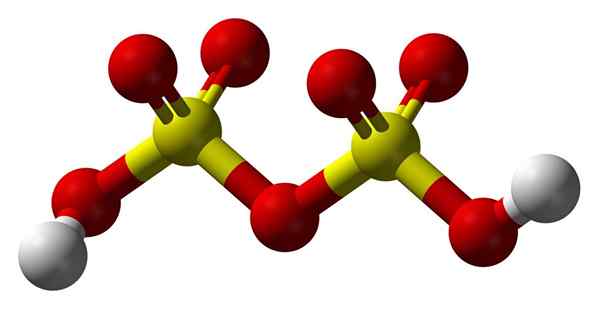
Disulfursäurestruktur
 Disulfursäurestruktur
Disulfursäurestruktur Hoch2S2ENTWEDER7 In einem Kugeln und Bars Modell. Beachten Sie die Symmetrie des Moleküls: Die linke Seite der Sauerstoffbrücke ist mit der rechten identisch. Aus dieser Perspektive kann die Struktur mit der HO -Formel beschrieben werden3Fade3H.
An beiden Enden befinden sich jede Hydroxylgruppe, deren Wasserstoff durch induktive Wirkung all dieser Sauerstoffatome seine positive Teilbelastung erhöht. Und folglich hat Disulfursäure noch stärker Säure als Schwefelsäure.
Kann Ihnen dienen: Kaliumhydroxid: Struktur, Eigenschaften, verwendetDas Molekül kann als h geschrieben werden2SW4· SW3. Dies bezieht sich jedoch mehr auf eine Zusammensetzung des Oleums als auf die Struktur eines Moleküls.
Wenn jedoch ein Wassermolekül zu H hinzugefügt wird2S2ENTWEDER7, Es werden zwei H -Moleküle freigesetzt2SW4:
H2S2ENTWEDER7 + H2Oder 2h2SW4
Das Gleichgewicht kann nach links wechseln: zur Bildung von h2S2ENTWEDER7 Von h2SW4 Wenn Wärme geliefert wird. Es ist aus diesem Grund, dass zu h2S2ENTWEDER7 Es ist auch als Pyrosulfursäure bekannt; da es nach dem Erhitzen von Schwefelsäure erzeugt werden kann.
Auch, wie am Anfang erwähnt, h2S2ENTWEDER7 Es wird durch die direkte Kombination von H gebildet2SW4 Und so3:
SW3 + H2SW4 H2S2ENTWEDER7
Eigenschaften
 Oleum. Quelle: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons
Oleum. Quelle: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons Die Eigenschaften von Disulfursäure sind nicht sehr gut definiert, da es äußerst schwierig ist, nur aus dem Öl isoliert zu werden.
Es sollte daran erinnert werden, dass es andere Verbindungen im Öl mit h h geben kann2SW4· Xso3, wo abhängig vom Wert von x sogar Polymerstrukturen haben kann.
Eine Möglichkeit, sich vorzustellen, besteht darin, sich vorzustellen, dass die obere Struktur von H2S2ENTWEDER7 wird durch mehr Einheiten von so verlängert3 und Sauerstoffbrücken.
In einem fast reinen Zustand besteht es aus einem instabilen kristallinen Feststoff (Rauchen), das bei 36 ° C schmilzt. Dieser Schmelzpunkt kann jedoch je nach wahrer Komposition variieren.
Disulfursäure kann so genannte Disulfate (oder Pyrosulfat) Salze bilden. Wenn Sie beispielsweise mit Kaliumhydroxid reagieren, bilden Sie Kaliumpyrosulfat, K2S2ENTWEDER7.
Darüber hinaus kann kommentiert werden, dass es ein Molekulargewicht von 178 g/mol und zwei Säureäquivalent (2 H -Ionen) aufweist+ das kann mit einer starken Basis neutralisiert werden).
Kann Ihnen dienen: VolatilisationZuckerdehydrationsreaktion
Mit dieser Ölverbindung kann eine merkwürdige Reaktion durchgeführt werden: Die Transformation von Kohlenstoffblockklumpen.
Die h2S2ENTWEDER7 Es reagiert mit Zucker, die alle seine OH -Gruppen in Form von Wasser beseitigen, was neue Gewerkschaften unter Kohlenstoffatomen begünstigt; Gewerkschaften, die schwarze Kohle verursachen.
Nomenklatur
Disulfursäure wird als Anhydrid von Schwefelsäure angesehen; Das heißt, es verliert ein Wassermolekülprodukt der Kondensation zwischen zwei Säuremolekülen. Vor so vielen möglichen Namen für diese Verbindung empfiehlt die IUPAC -Nomenklatur einfach die von Disulfursäure.
Der Begriff "Piro" spielt ausschließlich auf das, das als Produkt der Wärmeanwendung gebildet wurde. IUPAC berät diesen Namen nicht für h2S2ENTWEDER7; Aber es wird derzeit immer noch von vielen Chemikern verwendet.
Die Beendigung -ICO bleibt unveränderlich, da das Schwefelatom weiterhin eine Valenz von +6 beibehält. Zum Beispiel kann es durch den folgenden arithmetischen Betrieb berechnet werden:
2H + 2s + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Anwendungen
Speichert Schwefelsäure
Disulfursäure, angesichts ihrer Eigenschaft, sich als Öl zu verfestigen. Das liegt daran, dass das SO3 Es entkommt einen unwiderstehlichen "Nebel", der in H viel löslicher ist2SW4 als in Wasser. H2SW4, Es würde ausreichen, um dem Wasseröl hinzuzufügen:
H2S2ENTWEDER7 + H2Oder 2h2SW4
100% Schwefelsäure -Synthese
Aus der vorherigen Gleichung, h2SW4 Es ist im zusätzlichen Wasser verdünnt. Zum Beispiel, wenn Sie eine wässrige Lösung von H haben2SW4, Wo das so3 Es entzieht sich und stellt ein Risiko für Arbeiter dar, was Öl hinzufügt, um zu löschen. Dies reagiert mit Wasser, das mehr Schwefelsäure bildet. das heißt, die Konzentration zu erhöhen.
Es kann Ihnen dienen: Chemische undurchdringliche UneinigkeitWenn noch Wasser übrig ist, wird dies noch mehr hinzugefügt3, die mit H reagiert2SW4 mehr Disulfursäure oder Öl produzieren und dann wieder hydratisiert "das H -Trocknen"2SW4. Der Vorgang wiederholt das manchmal genug, um Schwefelsäure bei einer 100% igen Konzentration zu erhalten.
Ein ähnlicher Prozess wird verwendet, um 100% Salpetersäure zu erhalten. Ebenso wurde es verwendet, um andere chemische Substanzen zu dehydrieren, die zur explosiven Ausarbeitung verwendet werden.
Schwefelation
Strukturen wie Farbstoffen; das heißt, fügen Sie Gruppen hinzu -so3H, welcher Verlust Ihres Säureprotons kann am Textilfaserpolymer verankert werden.
Andererseits wird der Säure des Oleums verwendet, um die zweite Nitration zu erreichen (Gruppen -Nr. Hinzufügen2) zu den aromatischen Ringen.
Verweise
- Anorganische Chemie. (vierte Edition). Mc Graw Hill.
- Pyrosulfursäure. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- « 20 Erfindungen der Renaissance, die die Welt veränderte
- Bakterienabstrich Was ist, Eigenschaften und Vorbereitung »

