Phosphorsäure (H3PO3)
- 1917
- 371
- Frederike Birkemeyer
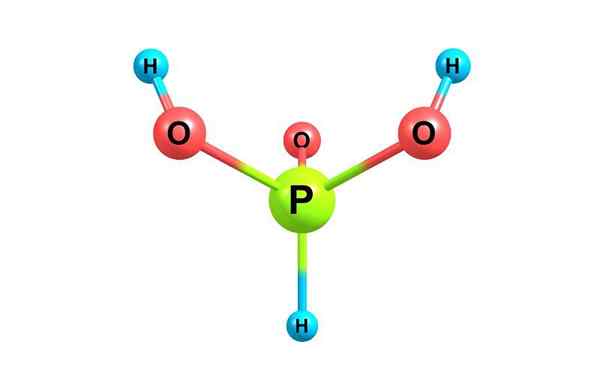
 Chemische Struktur von Phosphorsäure. Mit Lizenz
Chemische Struktur von Phosphorsäure. Mit Lizenz Was ist Phosphorsäure?
Er Phosphorsäure, Auch als Orthophosphatsäure bezeichnet, handelt es sich um eine chemische Verbindung der Formel H3Po3. Es ist eine der verschiedenen sauerstoffhaltigen Säuren des Phosphors und seine Struktur wird im oberen Bild dargestellt.
Angesichts der zusammengesetzten Formel kann dies als HPO (OH) neu geschrieben werden2. Diese Art existiert im Gleichgewicht mit einem kleinen Tautomer P (OH)3.
Die Empfehlungen von IUPAC, 2005, lautet, dass letzteres Phosphorsäure genannt wird, während die Dihydroxyform Phosphonsäure genannt wird. Nur reduzierte Phosphorverbindungen sind Zaubersprüche mit einer "Bären" -Pulsion.
Phosphorsäure ist eine diprotische Säure. Dies bedeutet, dass sie nur die Fähigkeit hat, zwei Protonen zu ergeben. Dies liegt daran, dass die Mehrheit Tautomer h ist3Po3.
Wenn diese Form ein Proton verliert, stabilisiert Resonanz die gebildeten Anionen. P (OH) Tautomero 3 hat nicht den Vorteil einer Resonanzstabilisierung. Dies erschwert die Beseitigung des dritten Protons viel schwieriger.
Phosphorsäure (H)3Po3) Verkäufe, die als Phosphite bezeichnet werden und als Reduktionsmittel verwendet werden. Es wird durch Auflösen von tetraphosphorischem Hexoxid (p) hergestellt (p)4ENTWEDER6) Gemäß der Gleichung:
P4ENTWEDER6 + 6 H₂O → 4 HPO (OH)2
Reine Phosphorsäure, h3Po3, Es wird besser durch Phosphor -Trichloridhydrolyse, PCL hergestellt3.
PCL3 + 3H2O → HPO (OH)2 + 3HCL
Die resultierende Lösung wird erhitzt, um die HCL auszuschließen, und das verbleibende Wasser verdunstet bis sie erscheint 3Po3 Kristalline bunt beim Abkühlen. Säure kann auch durch Wasserwirkung auf PBR erhalten werden3 oder pi3.
Physikalische und chemische Eigenschaften der Phosphorsäure
- Phosphorsäure ist ein weißer oder gelb hygroskopischer tetraedrischer Kristall mit einem Aroma, das dem Knoblauch ähnelt.
Kann Ihnen dienen: ungesättigte Lösung- Die h3Po3 Es hat ein Molekulargewicht von 82,0 g/mol und eine Dichte von 1.651 g/ml.
- Die Verbindung hat einen Schmelzpunkt von 73 ° C und zersetzt sich über 200 ° C.
- Es ist löslich in Wasser und kann in der Lage sein, 310 Gramm pro 100 ml dieses Lösungsmittels aufzulösen. Es ist auch in Ethanol löslich.
- Es ist eine starke Säure mit einem PKA zwischen 1,3 und 1,6.
- Heizphosphorsäure bei ungefähr 200 ° C macht sie in Phosphorsäure und Phosphin (pH) gegenproportional3). Phosphin ist ein Gas, das normalerweise spontan in der Luft eindringt.
4H3Po3 + Hitze → ph3 + 3H3Po4
Reaktivität und Gefahren
Reaktivität
- Phosphorsäure ist keine stabile Verbindung.
- Nehmen Sie Luftsauerstoff ab, um Phosphorsäure zu bilden.
- Bilden Sie gelbe Ablagerungen in wässriger Lösung, die beim Trocknen spontan entflammbar sind.
- Reagieren Sie exotherm mit chemischen Basen (z. B. anorganische Amine und Hydroxide), um Salze zu bilden.
- Diese Reaktionen können in kleinen Räumen gefährlich große Wärmemengen erzeugen.
- Wasserauflösung oder Verdünnung einer konzentrierten Lösung mit zusätzlichem Wasser kann erhebliche Wärme erzeugen.
- Reagiert in Gegenwart von Luftfeuchtigkeit mit aktiven Metallen, einschließlich Strukturmetallen wie Aluminium und Eisen, um Wasserstoff freizusetzen, ein brennbares Gas.
- Sie können mit der Polymerisation bestimmter Alkene beginnen. Reagiert mit Cyanidverbindungen, um gasförmige Wasserstoffcyanid freizusetzen.
- Es kann brennbare und / oder giftige Gase erzeugen, die mit Ditiokarbamaten, Isozialaten, Händlern, Nitriden, Nitrilen, Sulfiden und starken Reduktionsmitteln in Kontakt stehen.
- Zusätzliche Reaktionen zur Gaserzeugung werden mit Sulfiten, Nitriten, Thiosulfaten (um H2S und SO3 zu geben), Dionitos (um SO2 zu geben) und Carbonate (um Co₂ zu geben).
Es kann Ihnen dienen: Einstenio (s): Struktur, Eigenschaften, erhalten, verwendet, verwendetGefahren
- Die Verbindung ist korrosiv für Augen und Haut.
- Augenkontakt kann zu Hornhautschäden oder Blindheit führen.
- Hautkontakt kann Entzündungen und Blasen erzeugen.
- Die Inhalation des Staubes führt zu Reizungen des Magen -Darm- oder Atemwegs, das durch Verbrennen, Niesen und Husten gekennzeichnet ist.
- Eine schwere Überbelichtung kann zu Lungenschäden, Ersticken, Wissensverlust oder Tod führen.
Aktion bei Schäden
- Stellen Sie sicher, dass das medizinische Personal über die damit verbundenen Materialien informiert ist und Vorsichtsmaßnahmen zum Schutz.
- Das Opfer muss auf einen neuen Standort verlegt werden und den Notfalldienst anrufen.
- Künstliche Atmung sollte gegeben werden, wenn das Opfer nicht atmet.
- Die Methode zur Mund -zu -Mund -Methode sollte nicht angewendet werden, wenn das Opfer die Substanz aufgenommen oder eingeatmet hat.
- Künstliche Atmung wird mit Hilfe einer Taschenmaske durchgeführt, die mit einem unidirektionalen Ventil oder einem anderen angemessenen Atemgerät ausgestattet ist.
- Sauerstoff sollte verabreicht werden, wenn das Atmen schwierig ist.
- Kontaminierte Kleidung und Schuhe müssen entfernt und isoliert werden.
- Spülen Sie im Kontakt mit der Substanz die Haut oder die Augen sofort mit fließendem Wasser mindestens 20 Minuten lang ab.
- Für den Kontakt mit niedrigerer Haut sollte das Material auf der in eingestellten Haut vermieden werden.
- Halten Sie das Opfer ruhig und heiß.
- Die Auswirkungen der Exposition (Inhalation, Aufnahme oder Hautkontakt) können verzögert werden.
Verwendungen von Phosphorsäure
- Die wichtigste Verwendung von Phosphorsäure ist die Produktion von Phosphiten, die bei der Wasserbehandlung verwendet werden. Phosphorsäure wird auch zur Herstellung von Phosphitsalzen wie Kaliumphosphit verwendet.
Kann Ihnen dienen: Boyle Law- Phosphite haben die Wirksamkeit bei der Kontrolle einer Vielzahl von Pflanzen gezeigt.
- Insbesondere wird die Behandlung durch Injektion von Rumpf oder Blatt, das Phosphorsäuresalze enthält, als Reaktion auf Infektionen aufgrund von Pflanzenpathogenen von Phytoftera und Pythiumtyp angezeigt (erzeugen die Zersetzung der Wurzel).
- Phosphorsäure und Phosphite werden als Reduktionsmittel in der chemischen Analyse verwendet. Eine neue bequeme und skalierbare Synthese von Phenylessigsäuren durch die durch Mandelsäuresäure katalysierte Reduktion basiert auf der Erzeugung von Jodidechinsäure aus dem katalytischen Natriumiodid. Dafür wird Phosphorsäure als stöchiometrische Reduzierung verwendet.
- Es wird als Zutat für die Produktion von Zusatzstoffen, die in der Poli -Industrie verwendet werden (Vinylchlorid), verwendet werden. Auch die Ester der Phosphorsäure werden in mehreren Reaktionen der organischen Synthese verwendet.
Verweise
- Phosphorsäure (H3PO3). Von Britannica geborgen.com.
- Musonsäure. Von EBI geborgen.AC.Vereinigtes Königreich.

