Phosphorsäure (H3PO4)
- 2711
- 111
- Frederike Birkemeyer
 Individuelles Phosphorsäuremolekül
Individuelles Phosphorsäuremolekül Was ist Phosphorsäure?
Er Phosphorsäure Es ist eine Oxo -Säure des Phosphors, die eine chemische Formel H hat3Po4. Es besteht aus einer Mineralsäure, in der drei Säureprotonen mit dem Phosphatanion verbunden sind (PO43-). Obwohl es nicht als starke Säure angesehen wird, kann seine unangemessene Verwendung ein gesundheitliches Risiko haben.
Es kann in zwei Zuständen gefunden werden: als Feststoff in Form dicker ortorrombischer Kristalle oder als kristalliner Sirup -aussehender Flüssigkeit. Die üblichste kommerzielle Präsentation hat eine Konzentration von 85% P/P und eine Dichte von 1.685 g/cm3. Diese Dichte kommt von der Hand der Konzentration.
Die drei OH -Gruppen sind für die Spenden von Säure -Hydrogenen verantwortlich. Aufgrund ihrer Anwesenheit in ihrer Struktur können Sie mit verschiedenen Hydroxiden reagieren, die mehrere Salze verursachen.
Im Fall von Natriumhydroxid können Sie drei bilden: monobasisches Natriumphosphat (nah2Po4), Dibasisches Natriumphosphat (Na2HPO4) und tribasisches Natriumphosphat (Na3Po4).
Je nachdem, welche Basis für die Neutralisation verwendet wird oder welche Kationen sehr nahe stehen, können Sie andere Phosphatsalze bilden. Darunter sind: Calciumphosphat (CA)3(Po4)2), Lithiumphosphat (li3Po4) Eisen Phosphat (Fepo4), und andere. Jeweils mit seinen unterschiedlichen Protonierungsgraden des Phosphatanions.
Andererseits kann Phosphorsäure zweifeste Kationen wie den Glauben "entführen"2+, Cu2+, AC2+ und Mg2+. Bei hohen Temperaturen können Sie mit dem Verlust eines H -Moleküls mit sich selbst reagieren2Oder Durchmesser, Trimmer und Polymere von Phosphorsäuren.
Diese Art von Reaktion lässt diese Verbindung in der Lage, eine große Anzahl von Strukturen mit Phosphor- und Sauerstoff -Skelette zu etablieren, aus denen auch ein breites Spektrum bekannter Salze erhalten werden kann, wie z. B. Polyphosphate.
In Bezug auf seine Entdeckung wurde er 1694 von Robert Boyle (1627-1691) synthetisiert und löst sich auf2ENTWEDER5 (Phosphorpentoxid) im Wasser. Es ist eine der nützlichsten Mineralsäuren, die seine Funktion als Dünger ist.
Phosphor, Kalium und Stickstoff bilden die drei Hauptnährstoffe von Pflanzen.
Chemische Phosphorsäurstruktur
 Chemische Phosphorsäurstruktur
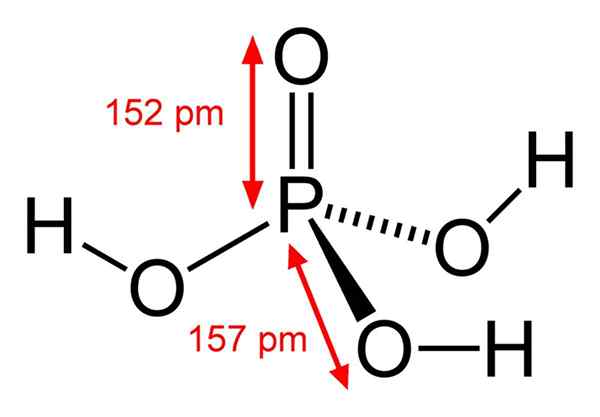
Chemische Phosphorsäurstruktur Phosphorsäure besteht aus einer P = O -Bindung. Mit dem Phosphoratom in der Mitte zeichnen Sauerstoff eine Art molekularer Tetraeder.
Auf diese Weise kann Phosphorsäure als Tetraeder sichtbar gemacht werden. Aus dieser Perspektive diese Tetraeder (durch H -Einheiten3Po4) durch Wasserstoffbrücken miteinander interagieren; Das heißt, ihre Eckpunkte nähern sich genau.
Diese intermolekularen Wechselwirkungen ermöglichen Phosphorsäurkristallin in zwei Feststoffen: wasserfrei und Hemihydrat (H)3Po4· 1/2h2O), beide mit monoklinen kristallinen Systemen. Seine Anhydra -Form kann auch mit der Formel beschrieben werden: 3H2Oder · p2ENTWEDER5, das entspricht einem trihydrierten Phosphorpentoxid.
Tetraeder kann sogar kovalent verbinden, aber für diese Einheiten muss ein Wassermolekül durch Dehydration eliminieren. Dies geschieht, wenn h3Po4 Es wird erhitzt und erzeugt als Folge der Bildung von Polyphosphärensäuren (PA).
Diposphorsäure (H)4P2ENTWEDER7)
Der einfachste aller PA ist Diposphorsäure (H)4P2ENTWEDER7), auch als Pyrophosphorsäure bekannt. Die chemische Gleichung Ihrer Formation ist wie folgt:
Es kann Ihnen dienen: Aluminiumphosphat (ALPO4): Struktur, Eigenschaften, erhalten, verwendet, verwendet2H3Po4 H4P2ENTWEDER7 + H2ENTWEDER
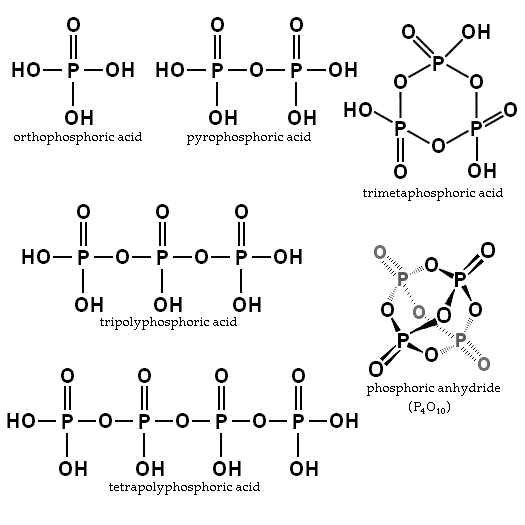
Der Restbetrag hängt von der Menge an Wasser und Temperatur ab. Was ist seine Struktur?? Im Bild des Abschnitts sind die Strukturen von orthophosphahisch und pyrophosphorsäure in der oberen linken Ecke dargestellt.
Zwei Einheiten beitreten kovalent, wenn ein Wassermolekül eliminiert wird, wodurch eine P-O-P-P-P-Sauerstoffbrücke zwischen ihnen bildet. Jetzt sind sie nicht drei Säurewasserstoff, sondern vier (vier Gruppen -OH). Aus diesem Grund h4P2ENTWEDER7 präsentiert vier K -Konstanten kZu.
Polyphosphorsäuren
Dehydration kann mit Pyrophosphorsäure fortgesetzt werden, wenn die Erwärmung fortgesetzt wird. Weil? Denn an jedem Ende seines Moleküls gibt es eine OH-Gruppe, die als Wassermolekül beseitigt werden kann, wodurch das anschließende Wachstum des P-O-O-O-P-Skeletts fördert ... P ..
Beispiele für diese Säuren sind Trimphosphor- und Tetropolifforsäuren (beide auch im vorherigen Bild dargestellt). Es ist zu sehen, wie sich das P-O-P-Skelett in einer Art von Kette verlängert, die von Tetraeder gebildet wird.
Diese Verbindungen können mit der Ho -Formel (PO) dargestellt werden2OH)XH, wo ho ist das linke Ende, das dehydrieren kann. Po2OH ist das Phosphor -Skelett mit den P = O- und OH -Links; Und x sind die Phosphorsäureinheiten oder Moleküle, die erforderlich sind, um die Kette zu erhalten.
Wenn diese Verbindungen vollständig neutralisiert sind, entstehen die sogenannten Polyphosphate. Je nachdem, welche Kationen sie umgeben sind, bilden sie eine Vielzahl von Polyphosphatsalzen.
Andererseits werden die Hydrogene ihres Skeletts durch die Alkylsubstituenten r ersetzt, wenn sie mit ROH -Alkoholen reagieren. R-. Somit entstehen Phosphatester (oder Polyphyse): ro (po2Oder)XR. Es reicht aus, das H durch r alle Strukturen des Bildes des Abschnitts zu ersetzen, um sie zu erhalten.
Zyklische Polyphosphorsäuren
P-O-P-Ketten können sogar in einem Ring- oder Phosphorzyklus geschlossen werden. Der einfachste dieser Art von Verbindung ist Trimethaphosphorsäure (die obere rechte Ecke des Bildes). Somit können PAs linear, zyklisch sein; oder wenn ihre Strukturen beide Arten aufweisen, verzweigt.
Nomenklatur
 Phosphorsäure. Quelle: Commons.Wikimedia.Org
Phosphorsäure. Quelle: Commons.Wikimedia.Org Die Nomenklatur von Phosphorsäure wird von IUPAC regiert und wie die Nullionssalze von Oxoäakidieren genannt werden.
Weil in h3Po4 Das Atom von P hat Valencia +5, das mit dem größten Wert, der Säure wird dem Suffix -ico dem Phosphorpräfix zugeordnet-.
Ortho-
Phosphorsäure wird jedoch auch allgemein auch Orthophosphorsäure erzählt. Weil? Weil das Wort 'ortho' griechisch ist und 'wahr' bedeutet; was zu der "wahren Form" oder "" mehr hydratisierter "desselben führen würde.
Wenn der Phosphoranhydro mit einem Wasserüberschuss hydratisiert ist (p)4ENTWEDER10, Das "überlegene Bild" Cap ")3Po4 (3H2Oder · p2ENTWEDER5). Somit wird das Ortho -Präfix an die Säuren vergeben, die mit reichlichem Wasser gebildet werden.
Piro-
Das PIRO-Präfix bezieht. Es wird daher Pyrophosphorsäure (2H2Oder · p2ENTWEDER5).
Ziel-
Das Zielpräfix, das auch ein griechisches Wort ist, bedeutet "Nachher". Es wird den Substanzen hinzugefügt, deren Formel ein Molekül beseitigt hat, in diesem Fall das von Wasser:
H3Po4 => HPO3 + H2ENTWEDER
Beachten Sie, dass diesmal die Zugabe von zwei Phosphoreinheiten nicht zur Bildung der Diposphorsäure auftritt, sondern anstelle der Metaphosphorsäure erhalten wird (aus der es keine Hinweise auf ihre Existenz gibt).
Kann Ihnen dienen: Ethylalkohol: Struktur, Eigenschaften, Verwendungen, ErhaltenEs ist auch wichtig hervorzuheben, dass diese Säure als H bezeichnet werden kann2Oder · p2ENTWEDER5 (Ähnlich wie Hemidrate, multiplizieren Sie HPO3 Für 2). Das Präfix-Meta-Meta ist nach dem cyclischen PAs perfekt3Po4 Um Tetraphosphorsäure zu werden, müssen Sie einen Ring bilden.
Und dies ist mit anderen Polyetophosphorsäuren gleich, obwohl die IUPAC empfiehlt.
Phosphorsäureigenschaften
Molekularformel
H3Po4
Molekulargewicht
97,994 g/mol
Aussehen
In seiner festen Form präsentiert es ortorrombische, hygroskopische und transparente Kristalle. In der flüssigen Form ist es kristallin, mit einem viskosen Sirup -Erscheinungsbild.
Kommerziell wird es in wässriger Lösung mit einer Konzentration von 85% p/p erreicht. In all diesen Präsentationen mangelt es an Geruch.
Koch- und Fusionspunkte
158º C (316º F A 760 mmHg).
42,2º c).
Wasserlöslichkeit
548 g/100 g H2Oder 20º C; 369,4 g/100 ml bei 0,5 ° C; 446 g/100 m bei 14,95º c.
Dichte
1,892 g/cm3 (solide); 1.841 g/cm3 (100%Lösung); 1.685 g/cm3 (85%Lösung); 1,334 g/cm3 50%Lösung) bei 25ºC.
Dampfdichte
Luftverhältnis 3.4 (Luft = 1).
Selbstzündung
Es ist nicht brennbar.
Schmiere
3,86 MPOISE (40% bis 20 ° C).
Säure
pH: 1,5 (0,1 N Lösung im Wasser)
PKA: PKA1 = 2,148; PKA2 = 7.198 und PKA3 = 12.319. Daher ist sein saurster Wasserstoff der erste.
Zersetzung
Wenn er erhitzt wird, veröffentlicht er Phosphoroxide. Wenn die Temperatur auf 213 ° C oder mehr steigt, wird sie Pyrophosphorsäure (h)4P2ENTWEDER7).
Korrosivität
Korrosiv für Eisen Metalle und Aluminium. Bei der Reaktion mit diesen Metallen stammt brennbares Wasserstoffgas.
Polymerisation
Gewalttätig Polymeriza mit Scherzverbindungen, Epoxiden und polymerisierbaren Verbindungen.
Phosphorsäure verwendet
Fosphat und General nutzt Verkäufe
-Phosphorsäure dient als Grundlage für die Phosphatausarbeitung, die als Düngemittel verwendet werden, da Phosphor ein Hauptnährstoff für Pflanzen ist.
-Es wurde bei der Behandlung von führender Vergiftungen und anderen Erkrankungen verwendet, unter denen wichtige Phosphatmengen und die Produktion von milder Azidose erforderlich sind.
-Es wird verwendet, um den pH -Wert von Nerz und Katzen im Harnweg zu kontrollieren, um die Bildung von Nierenberechnungen zu vermeiden.
-Phosphorsäure verursacht Na -Salze2HPO4 und Nein2Po4 die ein pH -Schockdämpfersystem mit einem PKA von 6,8 darstellen. Dieses pH -regulatorische System ist beim Menschen vorhanden, der für die Regulation des intrazellulären pH -Werts sowie für die Behandlung der Wasserstoffkonzentration in den distalen und Kollektor -Tubuli der Nephronen Bedeutung ist.
-Es wird zur Eliminierung der Mohosa -Schicht aus Eisenoxid verwendet, die sich auf diesem Metall ansammelt. Phosphorsäure bilden Eisenphosphat, das leicht von der Metalloberfläche entfernt werden kann. Es wird auch in Aluminium -Elektrikpolitur verwendet.
Industrielle
-Phosphorsäure ist als katalytisches Mittel zur Ausarbeitung von Nylon und Benzin bestimmt. Es wird als dehydrierendes Mittel in der lithografischen Gravur, bei der Ausarbeitung von Farbstoffen zur Verwendung in der Textilindustrie, im Prozess der Koagulation des Latex in der Uferindustrie und in der Reinigung von Wasserstoffperoxid (Wasserstoffperoxid (Wasserstoffperoxid) verwendet.
-Säure wird als Additiv in Erfrischungsgetränken verwendet, die auf diese Weise zu seinem Geschmack beitragen. Verdünnt, wird es im Zuckerverfeinerungsprozess angewendet. Es fungiert auch als Stoßdämpfersystem bei der Herstellung von Schinken, Gelatine und Antibiotika.
Kann Ihnen dienen: Aluminiumhydroxid: Struktur, Eigenschaften, Verwendungen, Risiken-Intervenes in die Ausarbeitung von Reinigungsmitteln in der Säuregatalyse der Acetylenproduktion.
-Es wird als Säuremittel in ausgewogenen Lebensmitteln für die Viehindustrie und die Haustiere verwendet. Die pharmazeutische Industrie verwendet sie bei der Herstellung von Antiemetik -Medikamenten. Es nutzt auch eine Mischung, um Asphalt zu machen, um den Boden zu ebnen und Risse zu reparieren.
-Phosphorsäure wirkt als Katalysator bei der Hydratationsreaktion von Alkenen zur Herstellung von Alkohol, hauptsächlich Ethanol. Darüber hinaus wird es zur Bestimmung der organischen Kohle in Böden verwendet.
Zahnärztlich
Es wird von Zahnärzten verwendet, um die Zahnoberfläche vor der Platzierung von Zahnstützen zu reinigen und zu konditionieren. Es findet auch die Verwendung bei Zahnaufhellung und die Beseitigung von Zahnplatten. Darüber hinaus wird es zur Herstellung von Kleber für Zahnprothesen verwendet.
Kosmetika
Phosphorsäure wird verwendet, um den pH -Wert bei der Ausarbeitung kosmetischer Produkte und zur Hautpflege einzustellen. Es wird als chemisches Oxidationsmittel zur Herstellung von Aktivkohle verwendet.
Phosphorsäurebildung
-Phosphorsäure wird mithilfe ihrer konzentrierten Schwefelsäureverdauung aus Apathit -Phosphatgesteinen hergestellt:
AC3(Po4)2 + 3 h2SW4 + 6 h2O => 2 h3Po4 + 3 (Fall4.2H2ENTWEDER)
Die Phosphorsäure, die in dieser Reaktion erhalten wurde.
-Phosphorsäure kann durch Auflösen von Phosphorpentoxid in kochendem Wasser auftreten.
-Es kann auch durch Erhitzen von Phosphor mit einer Mischung aus Luft- und Wasserdampf erhalten werden:
P4 (l) +5 o2 (g) => p4ENTWEDER10 (S)
P4ENTWEDER10 (s) +h2Oder (g) => 4h3Po4 (L)
Risiken
-Da Ihr Dampfdruck bei Raumtemperatur niedrig ist, ist es unwahrscheinlich, dass Ihre Dämpfe eingeatmet werden können, es sei denn, die Säure wird besprüht. Wenn ja, sind die Symptome ihrer Inhalation: Husten, Halsschmerzen, kurzlebige und mühsame Atmung.
-In der Literatur wird der Fall eines Seemanns, der Phosphorsäuredämpfe ausgesetzt war. Erlitt allgemeine Schwäche, trockene Husten, Brustschmerzen und Atemprobleme. Nach einem Jahr nach der Ausstellung wurde eine reaktive Dysfunktion des Atemwegs beobachtet.
-Hautkontakt mit Phosphorsäure kann Rötungen, Schmerzen, Blasen und Hautverbrennungen verursachen.
-Der Kontakt der Säure mit den Augen, abhängig von ihrer Konzentration und der Dauer des Kontakt.
-Die Einnahme von Säure verursacht Verbrennung in Mund und Hals, das Gefühlsgefühl von Begeisterung jenseits des Brustbeutels, Bauchschmerzen, Erbrechen, Schock und Zusammenbruch.
Verweise
- Royal Society of Chemistry. (2015). Phosphorsäure. Genommen von: Chemspider.com
- Kanadisches Gesundheits- und Berufssicherheitszentrum. (1999). Phosphorsäure - Gesundheitseffekte. Entnommen aus: CCSSO.AC
- Säuren.Die Info. (2018). Phosphorsäure -Vielfalt dieser chemischen Verbindung. Ausgenommen aus: Säuren.Die Info
- James p. Smith, Walter E. Brown und James R. Lehr. (1955). Struktur der kristallinen Phosphorsäure. J. BIN. Chem. SOC. 77, 10, 2728-2730
- Wikipedia. (2018). Phosphorsäuren und Phosphate. Genommen von: in: in.Wikipedia.Org
- Wissenschaft macht Spaß. Erfahren Sie mehr über Phosphorsäure. [PDF]. Genommen von: Scifun.Chem.Wisc.Edu

