Ameisensäure (HCOOH)
- 933
- 145
- Joe Hartwig
Wir erklären, was Ameisensäure, seine Eigenschaften, Struktur und Anwendungen ist
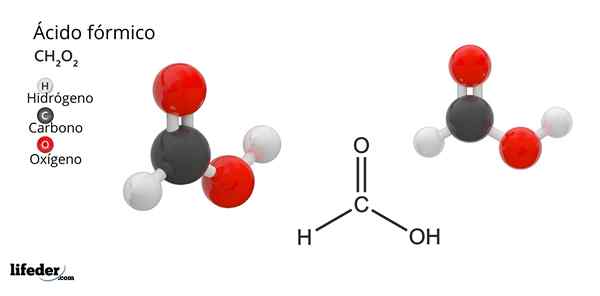
 Formel und Struktur von Ameisensäure
Formel und Struktur von Ameisensäure Was ist Ameisensäure?
Er Ameisensäure oder MethansäureEs ist die einfachste und kleine Verbindung aller organischen Säuren. Es ist auch als Methansäure bekannt und seine molekulare Formel ist HCOOH, die nur ein Wasserstoffatom mit dem Kohlenstoffatom verbunden ist. Sein Name stammt aus dem Wort Formica, was in lateinischer Bedeutung Ameise bedeutet.
Die Naturforscher des fünfzehnten Jahrhunderts stellten fest, dass bestimmte Arten von Insekten (Formícidos), wie Ameisen, Termiten, Bienen und Käfer, diese Verbindung absondern. Außerdem verwenden diese Insekten Ameisensäure als Mechanismus für Angriff, Verteidigung und chemische Beschilderung.
Sie haben giftige Drüsen, die diese und andere Säuren (zum Beispiel Essigsäure) wie einen Tau außerhalb des Tau. Ameisensäure ist stärker als Essigsäure (CH3Cooh); Daher erzeugt Ameisensäure Lösungen mit niedrigeren pH -Werten, die in gleichen Mengen in Wasser gelöst wurden.
Der englische Naturforscher John Ray erreichte 1671 die Isolierung der Ameisensäure und destentierte sie von großen Mengen an Ameisen.
Andererseits wurde die erste erfolgreiche Synthese dieser Verbindung vom französischen Chemiker und Physiker Joseph Gay-Lussac unter Verwendung von Nachtsäure (HCN) als Reagenz durchgeführt.
Wo ist Ameisensäure?
 Ameisen sezern
Ameisen sezern Ameisensäure kann in terrestrischen Ebenen als Bestandteil der Biomasse oder in der Atmosphäre vorhanden sein, die an einem breiten Spektrum chemischer Reaktionen beteiligt sind. Es kann sogar unter den Böden, in Öl oder in einer Gasphase auf seiner Oberfläche gefunden werden.
In Bezug auf Biomasse sind Insekten und Pflanzen die Hauptgeneratoren dieser Säure. Wenn fossile Brennstoffe verbrannt werden, produzieren sie gasförmige Ameisensäure; Folglich füllen Fahrzeugmotoren Ameisensäure in die Atmosphäre.
Die Erde beherbergt jedoch eine exorbitante Anzahl von Ameisen, und unter all diesen können in einem Jahr tausend so die Menge an Ameisensäure produzieren, die von der menschlichen Industrie erzeugt wird. Auch Waldbrände repräsentieren gasförmige Ameisensäurequellen.
Es kann Ihnen dienen: Lithium: Geschichte, Struktur, Eigenschaften, Risiken und VerwendungOben in der komplexen atmosphärischen Matrix treten photochemische Prozesse auf, die Formonsäure synthetisieren.
Zu diesem Zeitpunkt werden viele flüchtige organische Verbindungen (VOCs) unter den Auswirkungen der ultravioletten Strahlung abgebaut oder durch freie Radikalmechanismen OH oxidiert. Die reiche und komplexe atmosphärische Chemie ist bei weitem die vorherrschende Quelle formaler Ameisensäure.
Ameisensäurestruktur
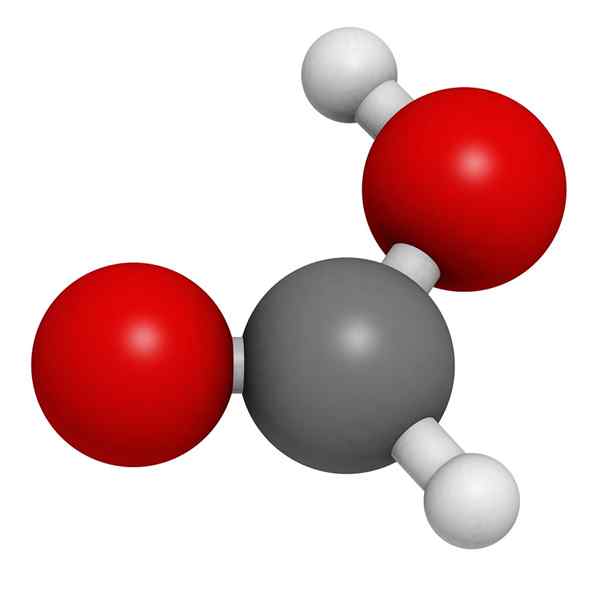 Molekularmodell von Ameisensäure
Molekularmodell von Ameisensäure Im überlegenen Bild wird die Struktur einer Gasphase von Ameisensäure veranschaulicht. Weiße Kugeln entsprechen Wasserstoffatomen, rotem Sauerstoff und schwarzen Atomen zu Kohlenstoffatomen.
In diesen Molekülen können zwei Gruppen geschätzt werden: Hydroxyl (-OH) und Formil (-ch = O), beide in der Lage, Wasserstoffbrücken zu bilden.
Diese Wechselwirkungen sind vom O-H-O-Typ, da die Hydroxil-Gruppen die Spender der H und die Gruppen die Spender des OR bilden.
H, das mit dem Kohlenstoffatom verbunden ist, fehlt jedoch diese Kapazität. Diese Wechselwirkungen sind sehr stark und aufgrund des Atoms von H -schlecht in Elektronen ist der Wasserstoff der OH -Gruppe saurer; Daher stabilisiert dieser Wasserstoff Brücken weiter.
Infolge des Vorstehenden existiert Ameisensäure in einer Bolzenform und nicht als individuelles Molekül.
Kristalline Struktur
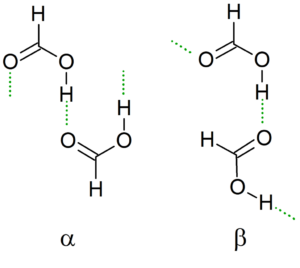
Wenn die Temperatur abfällt, führt das Dimer seine Wasserstoffbrücken, um zusammen mit den anderen Dimeren die stabilste mögliche Struktur zu erzeugen, wodurch unendliche Ketten α und β von Ameisensäure erzeugt werden.
Eine weitere Nomenklatur sind die Konformere "cis" und "trans". In diesem Fall wird "CIS" verwendet, um Gruppen zu bezeichnen, die in die gleiche Richtung orientiert sind, und "trans" für diese Gruppen in gegenteiligen Adressen.
Kann Ihnen dienen: Tanteo Balance: Schritte, Beispiele und ÜbungenZum Beispiel in der α -Kette "Punkt" auf die gleiche Seite (links) im Gegensatz zur β -Kette, wobei diese Formylgruppen auf entgegengesetzte Seiten zeigen (überlegenes Bild).
Diese kristalline Struktur hängt von den physikalischen Variablen ab, die darauf wirken, wie Druck und Temperatur. Somit sind Ketten konvertierbar; Das heißt, unter verschiedenen Bedingungen kann eine CIS -Kette in eine „Trans“ -Kette umgewandelt werden und umgekehrt.
Wenn Drücke auf drastische Werte zunehmen, werden die Ketten so komprimiert, dass sie als kristallines Polymer von Ameisensäure betrachtet werden.
Ameisensäureeigenschaften
Die physikalischen und chemischen Eigenschaften von Ameisensäure werden nachstehend erwähnt:
- Ameisensäure ist eine Flüssigkeit bei Raumtemperatur, farblos und mit einem starken und durchdringenden Geruch. Es hat ein Molekulargewicht von 46 g/mol, schmilzt auf 8,4 ° C und hat einen Siedepunkt von 100,8 ° C, größer als der von Wasser.
- Es ist in Wasser- und polaren organischen Lösungsmitteln wie Ether, Aceton, Methanol und Ethanol mischbar.
- Andererseits ist es in aromatischen Lösungsmitteln (wie Benzol und Toluol) leicht löslich, da die Ameisensäure kaum ein Kohlenstoffatom in seiner Struktur hat.
- Es hat eine PKA von 3,77, mehr saure als die von Essigsäure, was erklärt werden kann. Dies führt zu einem leichten Abstieg in der Säure des Protons (CH3Cooh, HcoOH).
- Die Säure entließ die Säure, dies wird zum Anion HCOO -Format-, Dies kann die negative Belastung zwischen den beiden Sauerstoffatomen demoziieren. Daher ist es ein stabiles Anion und erklärt die große Säure von Ameisensäure.
Reaktionen
Ameisensäure kann in Kohlenmonoxid (CO) und Wasser dehydratisiert werden. In Gegenwart von Platinkatalysatoren kann es auch in molekularen Wasserstoff- und Kohlendioxid zersetzen:
HCOOH (L) → H2(g) + co2(G)
Diese Eigenschaft ermöglicht es, dass Ameisensäure als sichere Möglichkeit betrachtet werden, Wasserstoff zu speichern.
Ameisensäure verwendet/Anwendungen
Die Lebensmittel- und Landwirtschaftsbranche
Obwohl schädliche Ameisensäure sein kann, wird sie in angemessenen Konzentrationen als Konservierungsmittel in Nahrung aufgrund seiner antibakteriellen Wirkung verwendet. Aus dem gleichen Grund wird es in der Landwirtschaft verwendet, wo es auch eine Pestizidaktion hat.
Es präsentiert auch Konservierungswirkung auf Weiden, die dazu beitragen, Darmgase bei Zuchttieren zu verhindern.
Die Textil- und Schuhindustrie
Es wird in der Textilindustrie in der Färbung und Verfeinerung von Textilien verwendet, die möglicherweise die häufigste Verwendung dieser Säure -Säure.
Ameisensäure wird in der Lederverarbeitung aufgrund ihrer miserablen Wirkung und in der Haarausscheidung dieses Materials verwendet.
Verkehrssicherheit auf Straßen
Zusätzlich zu den angegebenen industriellen Verwendungszwecken werden im Winter in der Schweiz und Österreich auf Straßen auf den Straßen der Schweiz und Österreich verwendet, um das Risiko von Unfällen zu verringern. Diese Behandlung ist effizienter als die Verwendung von gemeinsamem Salz.
Verweise
- Tellus (1988). Atmosphärische Formik aus Formikameisen: eine vorläufige Bewertung408, 335-339.
- B. Millet et al. (2015). Quellen und Senken von atmosphärischer Ameisensäure. Atmos. Chem. Phys., 15, 6283-6304.
- Wikipedia. (2018). Ameisensäure. Abgerufen von.Wikipedia.Org
- Aktiv. Ameisensäure. Von Actipedia geborgen.Org
- DR. N. K. Patel. Änderung: 2, Vortrag: 7. Ameisensäure. Nptel geborgen.AC.In
- Jean und Fred. (14. Juni 2017). Die Temites der Hügel verlassen. [Figur]. Geborgen von: Flickr.com

