Starke Säure
- 971
- 101
- Tizian Liebich
 Eine starke Säure ist eine Säure, die vollständig in konstanter Druck und Temperaturlösung dissoziiert wird
Eine starke Säure ist eine Säure, die vollständig in konstanter Druck und Temperaturlösung dissoziiert wird Was ist eine starke Säure?
A starke Säure Es handelt+. So reaktiv zu sein, eine große Anzahl von Arten ist gezwungen, diese h zu akzeptieren+, wie Wasser, dessen Mischung mit einfachem körperlichen Kontakt möglicherweise gefährlich wird.
Die Säure spendet ein Proton an das Wasser, das als Grundlage zur Bildung des Hydrium -Ions, h arbeitet3ENTWEDER+. Die Konzentration des Hydroniumions in einer Lösung einer starken Säure ist gleich der Säurekonzentration ([H)3ENTWEDER+] = [HAC]).
Je höher die Konzentration einer Säure (schwach oder stark) ist, es muss in ihrer Manipulation vorsichtiger sein. Deshalb zeigen die Flaschen von Salpetern oder Schwefelsäuren das Piktogramm einer Hand, die durch korrosive Eigenschaft eines Säureabtropfens verletzt werden.
Starke Säuren sind Substanzen, die mit vollem Bewusstsein ihrer möglichen Wirkungen manipuliert werden müssen. Wenn Sie sorgfältig mit ihnen arbeiten.
Eigenschaften einer starken Säure
Dissoziation
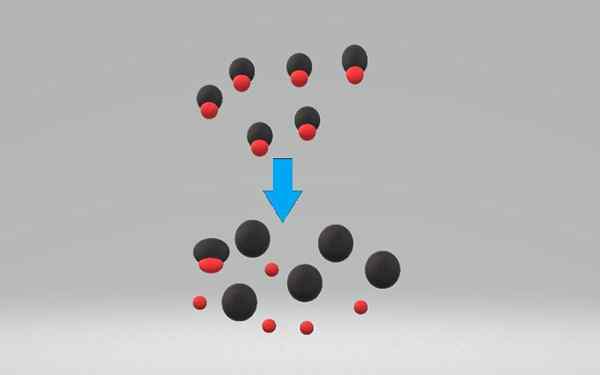
Eine starke Säure dissoziiert oder Ioniza in 100% in wässriger Lösung, wodurch einige Elektronen akzeptiert werden. Die Dissoziation einer Säure kann mit der folgenden chemischen Gleichung schematisieren:
HAC +H₂O => a- + H3ENTWEDER+
Wo ist stark Säure und- Ihre konjugierte Basis.
Die Ionisierung einer starken Säure ist ein Prozess, der normalerweise irreversibel ist. In schwachen Säuren im Gegenteil ist die Ionisierung reversibel. Die Gleichung zeigt, dass der H₂O derjenige ist, der das Proton akzeptiert. Die Alkohole und andere Lösungsmittel können dies jedoch auch tun.
Kann Sie servieren: Trockener BatterieDiese Tendenz, Protonen zu akzeptieren.
pH
Der pH -Wert einer starken Säure ist sehr niedrig und liegt zwischen 0 und 1 pH -Einheiten. Zum Beispiel eine HCL 0 -Lösung.1 m hat einen pH von 1.
Dies kann durch die Verwendung der Formel nachgewiesen werden
PH = - log [h+]
Sie können den pH -Wert einer HCl 0 -Lösung berechnen.1 m, dann anwenden
ph = -log (0.1)
Erhalten eines pH von 1 für die HCl 0 -Lösung.1 m.
PKA
Die Stärke der Säuren hängt mit ihrem PKA zusammen. Das Hydriumion (h3ENTWEDER+) hat zum Beispiel eine PKA von -1.74. Im Allgemeinen haben starke Säuren PKA mit mehr negativen Werten als -1.74 und sind daher mehr Säuren als H selbst3ENTWEDER+.
PKA exprimiert in gewisser Weise den Trend der Säure zu dissoziieren. Je niedriger sein Wert ist, desto lauter und aggressiv ist saure. Aus diesem Grund ist es zweckmäßig, die relative Stärke einer Säure durch den Wert ihrer PKA auszudrücken.
Korrosion
Im Allgemeinen werden starke Säuren als ätzend katalogisiert. Es gibt jedoch Ausnahmen für diese Annahme.
Zum Beispiel ist Fluorhorsäure eine schwache Säure, und dennoch ist sie äußerst ätzend und in der Lage, Glas aufzulösen. Aus diesem Grund müssen Sie in Plastikflaschen und niedrigen Temperaturen manipulieren.
Im Gegenteil.
Faktoren, die eine starke Säure beeinflussen
Elektronegativität seiner konjugierten Basis
Wenn eine rechte Verschiebung in einem Periodenzisch -Zeitraum auftritt.
Kann Ihnen dienen: Adsorptionsisothermen: Konzept, Typen, BeispieleDie Beobachtung von Periode 3 der Periodenziel -Tabelle zeigt beispielsweise, dass Chlor elektronegativer ist als Schwefel, und der Schwefel ist wiederum elektronegativer als Phosphor.
Dies stimmt mit der Tatsache überein, dass Salzsäure stärker ist als Schwefelsäure und letztere stärker als Phosphorsäure.
Durch Erhöhen der Elektronegativität der Konjugatbase der Säure erhöht sie die Stabilität der Base und verringert daher seine Tendenz zu einer Neugruppe mit Wasserstoff, um die Säure zu regenerieren.
Andere Faktoren sollten jedoch berücksichtigt werden, da dies nicht allein entscheidend ist.
Konjugates Basisradio
Die Säurekraft hängt auch vom Radius ihrer konjugierten Base ab. Gruppe VIIa Beobachtung der Periodenzüchtertabelle (Halogenos) zeigt, dass die atomaren Radios der Elemente, die die Gruppe bilden.
Ebenso halten die Säuren, die bilden, die gleiche abnehmende Reihenfolge der Kraft der Säuren:
Hi> hbr> hcl> hf
Zusammenfassend lässt sich sagen.
Dies wird bei der Schwächung des H-AC-Glieds durch schlechte Überlappung ungleicher atomarer Orbitale in der Größe erklärt.
Anzahl der Sauerstoffatome
Die Kraft einer Säure innerhalb einer Reihe von Oxaziden hängt von der Anzahl der Sauerstoffatome ab, die die konjugierte Base haben.
Kann Ihnen dienen: 10 Beispiele für nicht -polare kovalente VerbindungenDie Moleküle mit der größten Anzahl von Sauerstoffatomen bilden die Spezies mit größerer saurer Kraft. Zum Beispiel Salpetersäure (HNO3) Es ist eine stärkere Säure als Liegensäure (HNO2).
Andererseits Perklorsäure (HCLO4) ist eine stärkere Säure als Chlorsäure (HCLO3). Und schließlich ist Hypochlorsäure (HCLO) die niedrigere Säure in der Serie.
Beispiele für starke Säuren
- Yodhydrische Säure (HI)
- Bromhydsäure (HBR)
- Perchlorsäure (HCLO4)
- Salzsäure (HCL)
- Schwefelsäure (h2SW4)
- P-Toluenosulfonsäure (Cho3C6H4SW3H)
- Salpetersäure (HNO3)
- Bromsäure (Hbro3)
- Yodiumsäure (HIO3)
- Chlorsäure (HCLO3)
- Lessrosensäure (HNO2)
- Fluorantimonsäure (H [SBF6]
- Fluorosulfonsäure (FSO3H)
- Trifluormethanosulfonsäure (vgl3SW3H)
- Magic Säure (FSO3Hsbf5)
Verweise
- Eigenschaften, die die Säurefestigkeit bestimmen. Von Shmop geborgen.com
- Helmestine, Anne Marie. Starke Säure -Definition und Beispiel. Von Thakedco erholt.com

