Hypochlorsäure (HCLO) Struktur, Eigenschaften, Verwendungszwecke, Synthese
- 800
- 71
- Frederike Birkemeyer
Er Hypochlorsäure Es ist eine anorganische Verbindung, deren chemische Formel HCLO ist. Es entspricht mindestens rostig von Chloroxoäakiden, da es nur ein Sauerstoffatom enthält. Von ihm leiten Sie den Hypochloritanion ab, Clo-, und seine Salze, die weit verbreitet als kommerzielle Wasserdesinfektionsmittel verwendet werden.
Der HCLO ist das stärkste oxidierende und antimikrobielle Mittel, als wenn sich das gasförmige Chlor in Wasser auflöst. Seine antiseptische Wirkung ist seit mehr als einem Jahrhundert bekannt, noch bevor Chlorlösungen verwendet wurden, um die Wunden von Soldaten im Ersten Weltkrieg zu reinigen.
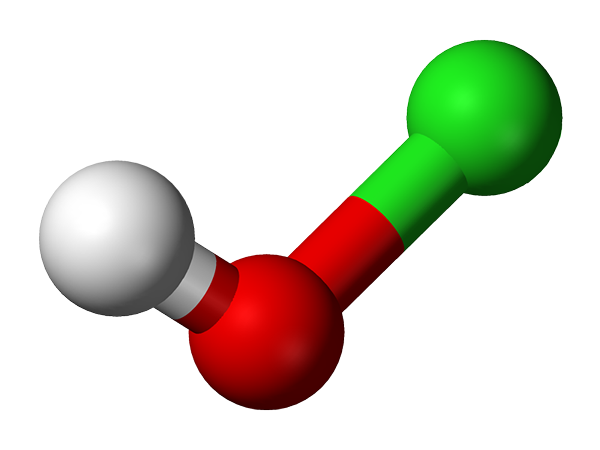
 Hypoklores Säuremolekül, das durch ein Kugeln und Balkenmodell dargestellt wird. Quelle: Ben Mills und Jynto [Public Domain]
Hypoklores Säuremolekül, das durch ein Kugeln und Balkenmodell dargestellt wird. Quelle: Ben Mills und Jynto [Public Domain] Seine De -facto -Entdeckung stammt aus dem Jahr 1834 durch den französischen Chemiker Antoine Jérôme Balard, der die teilweise Oxidation von Chlor in einer wässrigen Suspension von Quecksilberoxid, Hgo, erzielte. Seitdem wurde es als Desinfektionsmittel und antivirales Mittel verwendet.
Chemisch gesehen ist das HCLO ein Oxidationsmittel, das sein Chloratom anderen Molekülen verleiht. Das heißt, mit ihm können chlorierte Verbindungen synthetisiert werden, was Chloramine von großer Relevanz bei der Entwicklung neuer Antibiotika ist.
In den 70er Jahren wurde festgestellt, dass der Körper diese Säure durch die Wirkung des Myeloperoxidase -Enzyms auf natürliche Weise produzieren kann. Enzym, das auf Peroxide und Chloridanionen während der Phagozytose wirkt. Aus demselben Organismus kann dieser "Mörder" von Eindringlingen entstehen, aber für seinen eigenen Brunnen harmlos.
[TOC]
Struktur
Die HCLO -Struktur zeigt im oberen Bild. Beachten Sie, dass die Formel der Struktur widerspricht: Das Molekül ist H-O-Cl und kein H-Cl-O; Letzteres wird jedoch normalerweise bevorzugt, es direkt mit seinen am meisten oxidierten Gegenstücken vergleichen zu können: HCLO2, HCLO3 Und HCLO4.
 Chemische Struktur der hypochlorischen Säure.
Chemische Struktur der hypochlorischen Säure. Saurer Wasserstoff, h+, Der vom HCLO veröffentlichte HCLO befindet sich in der OH -Gruppe, die mit dem Chloratom verbunden ist. Beachten Sie die bemerkenswerten Längenunterschiede in den O-H- und CL-O-Glieder, wobei letztere aufgrund des geringeren Überlappungsgrades von Chlororbitalen am längsten sind, diffuser, mit denen des Sauerstoffs.
Das HoCL -Molekül kann unter normalen Bedingungen kaum stabil bleiben; Es kann nicht aus seinen wässrigen Lösungen isoliert werden, ohne als ein gasförmiges Chlor, CL2.
Daher gibt es keine wasserfreien Kristalle (nicht einmal Hydrate von ihnen) von hypochlorischer Säure; Und bis heute gibt es keine Anzeichen dafür, dass sie mit extravaganten Methoden vorbereitet werden können. Wenn zu kristallisieren, würden HCLO -Moleküle durch ihre permanenten Dipole (orientierte negative Belastungen in Richtung Sauerstoff) miteinander interagieren.
Es kann Ihnen dienen: Cyclohexen: Struktur, Eigenschaften, Synthese und VerwendungEigenschaften
Säure
HCLO ist eine monoprotische Säure; Das heißt, Sie können nur ein h spenden+ In die wässrige Umgebung (wo sie gebildet wird):
HCLO (AC) + H2Oder ↔ clo-(Ac) + h3ENTWEDER+(AC) (PKA = 7,53)
Aus dieser Gleichgewichtsgleichung wird beobachtet, dass eine Abnahme der H -Ionen3ENTWEDER+ (Ein Anstieg der Basizität der Umwelt) begünstigt die Bildung von mehr Hypochloritanionen, CLO-. Wenn Sie folglich eine Lösung von CLO relativ stabil halten möchten- Es ist notwendig, dass der pH -Wert grundlegend ist, was mit NaOH erreicht wird.
Seine Dissoziationskonstante PKA ist sich bewusst, dass der HCLO eine schwache Säure ist. Wenn wir es konzentriert haben, sollten wir uns daher nicht so sehr um H -Ionen kümmern3ENTWEDER+, aber durch die HCLO selbst (angesichts seiner hohen Reaktivität und nicht durch seine Korrosivität).
Oxidationsmittel
Es wurde erwähnt, dass das Chloratom im HCLO eine Oxidationszahl von +1 hat. Dies bedeutet, dass es kaum den Gewinn eines einzelnen Elektrons erfordert, um in seinen Grundzustand zurückzukehren (CL)0) und in der Lage sein, das CL -Molekül zu bilden2. Folglich wird der HCLO auf CL reduziert2 und h2Oder oxidieren einer anderen Spezies schneller als mit demselben CL2 oder clo-:
2HCLO (AC) + 2H+ + 2e- ↔ Cl2(g) + 2h2Oder (l)
Diese Reaktion ermöglicht es Ihnen, den HCLO in seinen wässrigen Lösungen stabil zu sehen.
Seine oxidierende Kraft wird nicht nur an der Bildung von CL gemessen2, aber auch für seine Fähigkeit, sein Chloratom aufzugeben. Beispielsweise können Sie mit Stickstoffspezies (einschließlich Ammoniak- und Stickstoffbasen) reagieren, um Chloramine zu verursachen:
HCLO + N-H → N-Cl + H2ENTWEDER
Beachten Sie, dass ein N-H-Link, eine Amino-Gruppe (-nh gebrochen ist (-nh)2) meistens und wird durch einen N-Cl ersetzt. Gleiches gilt für die O-H-Bindungen von Hydroxylgruppen:
HCLO + O-H → O-Cl + H2ENTWEDER
Diese Reaktionen sind entscheidend und erklären die Desinfektionsmittel und die antibakterielle Wirkung des HCLO.
Stabilität
HCLO ist fast dort instabil, wo er aussieht. Zum Beispiel ist Hypochloritanion in Chlorspezies mit Oxidationszahl von -1 und +5 unverhältnismäßig, stabiler als +1 im HCLO (H+Cl+ENTWEDER2-):
3cl-(Ac) ↔ 2cl-(ac) + clo3-(Ac)
Diese Reaktion würde das Gleichgewicht zum Verschwinden des HCLO bewegen. Außerdem nimmt der HCLO direkt mit Wasser und Chlorgas parallele Gleichgewicht teil:
Kann Ihnen dienen: FusionCl2(g) + h2Oder (l) ↔ HCLO (AC) + H+(Ac) + cl-(Ac)
Deshalb führt der Versuch, eine HCLO -Lösung zu erhitzen, um sie zu konzentrieren (oder zu isolieren), zur Produktion von CL2, das wird durch ein gelbes Gas identifiziert. Ebenso können diese Lösungen nicht zu lange Licht oder dem Vorhandensein von Metalloxiden ausgesetzt werden, da sie den CL abbauen2 (HCLO verschwindet noch mehr):
2cl2 + 2H2O → 4HCl + o2
Die HCl reagiert mit dem HCllo, um mehr CL zu erzeugen2:
HCLO + HCl → Cl2 + H2ENTWEDER
Und so weiter, bis mehr HCLO vorhanden ist.
Synthese
Wasser und Chlor
Eine der Methoden zur Herstellung oder Synthese hypochlorischer Säure wurde bereits implizit erklärt: das Auflösen von Gaschlor in Wasser auflösen. Eine weitere ziemlich ähnliche Methode besteht darin, das Anhydrid dieser Säure in Wasser aufzulösen: das Dichlormonoxid, CL2ENTWEDER:
Cl2Oder (g) + h2Oder (l) ↔ 2HCLO (AC)
Auch hier gibt es keine Möglichkeit, den reinen HCLO zu isolieren, da es verdunstet, dass das Wasser das Gleichgewicht zur Bildung von CL verdrängen würde2Oder Gas, das aus dem Wasser entkommen würde.
Andererseits war es möglich, konzentriertere Lösungen von HCLO (bei 20%) unter Verwendung von Quecksilberoxid, HGO, vorzubereiten. Dazu löst sich Chlor in einem Wasservolumen genau an seinem Gefrierpunkt auf. Dann wird das gleiche Eis gerührt und während des Schmelzens wird es mit dem HGO gemischt:
2cl2 + Hgo + 12h2O → 2HCLO + HGCL2 + 11H2ENTWEDER
20% HCLO -Auflösung kann endlich in einem Vakuum destilliert werden.
Elektrolyse
Eine einfachere und sicherere Methode zur Herstellung hypochlorischer Säurelösungen besteht darin, Salmuelas als Rohstoff anstelle von Chlor zu verwenden. Die Salmueras sind reich an Chloridanionen, CL-, Welcher durch einen Elektrolyseprozess oxidieren kann2:
2H2O → o2 + 4H+ + 4e- -
2cl- - ↔ 2e- - + Cl2
Diese beiden Reaktionen treten in der Anode auf, wobei das Chlor, das sich sofort auflöst, um HCLO zu stammen, erzeugt wird; Während im Kathodenraum wird Wasser reduziert:
2H2O + 2e- - → 2OH- - + H2
Auf diese Weise kann der HCLO im kommerziellen bis industriellen Maßstab synthetisiert werden. Und diese von Salmueras erhaltenen Lösungen sind in der Tat die auf dem Markt dieser Säure erhältlichen Produkte.
Anwendungen
Allgemeine Merkmale
HCLO kann als Oxidationsmittel verwendet werden, um Alkohole gegenüber Ketonen zu oxidieren und Chloramine, Chloramide oder Hydrochlore zu synthetisieren (ab Alkenen).
Alle anderen Verwendungen können jedoch in einem Wort eingebaut werden: Biocida. Er ist ein Pilz, Bakterien, Viren und A -Toxine, die von Krankheitserregern freigesetzt werden.
Es kann Ihnen dienen: Maleicosäure: Struktur, Eigenschaften, erhalten, verwendet, verwendetDas Immunsystem unseres Körpers synthetisiert seinen eigenen HCLO durch die Wirkung des Myeloperoxidase -Enzym.
Infinitäten von Studien schlagen verschiedene Mechanismen der HCLO -Wirkung auf die biologische Matrix vor. Dadurch spendet sein Chloratom an die Aminogruppen bestimmter Proteine und oxidiert auch ihre SH-Gruppen, die S-S-Disulfide vorhanden sind, was zur Denaturierung von ihnen führt.
Es stoppt auch die DNA -Replikation, indem es mit Stickstoffbasen reagiert, sie beeinflusst die vollständige Oxidation von Glucose und kann auch die Zellmembran deformieren. Alle diese Aktionen verursachen den Keimen den Tod.
Desinfektion und Reinigung
Deshalb werden HCLO -Lösungen für:
-Behandlung von Infektions- und Gangrenas -Wunden
-Desinfizieren Sie die Wasserversorgung
-Sterilisierungsmittel von chirurgischem Material oder Werkzeuge, die in Veterinär, Medizin und Zahnmedizin verwendet werden
-Desinfektionsmittel jeglicher Art von Oberfläche oder Objekt im Allgemeinen: Balken, Handläufe, Kaffeemaschinen, Keramik, Glastische, Labor Gasthaus usw.
-Synthese Chloramine, die als weniger aggressive Antibiotika dienen, aber gleichzeitig haltbarer, spezifischer und stabiler als HCLO selbst
Risiken
HCLO -Lösungen können gefährlich sein, wenn sie sehr konzentriert sind, da sie heftig mit Spezies reagieren können, die wahrscheinlich oxidieren können. Darüber hinaus neigen sie dazu, Gas Chlor durch Destabilisierung freizusetzen, sodass sie unter einem strengen Sicherheitsprotokoll gespeichert werden müssen.
Der HCLO ist so reaktiv gegenüber den Keimen, dass dort, wo er bewässert wird. Das gleiche geschieht im Organismus: Es wird schnell abgebaut oder durch jede Art der biologischen Umgebung neutralisiert.
Wenn der Organismus selbst erzeugt, ist es vermutbar, dass dies niedrige HCLO -Konzentrationen tolerieren kann. Wenn es jedoch sehr konzentriert ist (verwendet für synthetische und nicht -disinfekte Zwecke), kann dies zu unerwünschten Effekten führen, indem auch gesunde Zellen angreift (zum Beispiel Haut).
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Gottardi, w., Debabov, d., & Nagl, m. (2013). N-Chloramine, eine vielversprechende Klasse gut topischer Anti-Infektiven. Antimikrobielle Mittel und Chemotherapie, 57 (3), 1107-1114. Doi: 10.1128/AAC.02132-12
- Von Jeffrey Williams, Eric Rasmussen & Lori Robins. (6. Oktober 2017). Hypochlorsäure: Eine angeborene Reaktion nutzen. Erholt von: InfectionControl.Tipps
- Hydro -Instrumente. (S.F.). Grundchemie der Chlorierung. Abgerufen von: Hydroinstrts.com
- Wikipedia. (2019). Hypochlorsäure. Abgerufen von: in.Wikipedia.Org
- Serhan Sakarya et al. (2014). Hypochlorische Säure: Ein ideales Wundverwaltungsmittel mit starkem Mikrobizid, Antibiofilm und Wundheilung Potenz. HMP -Wunden. Erholt von: WundsResearch.com
- Prebchem. (2016). Herstellung hypochlorischer Säure. Erholt von: Primchem.com
- « 15 Vorteile von Äpfeln für körperliche und psychische Gesundheit
- Erdmagnetfeldherkunft, Eigenschaften, Funktion »

