Hyposulfurosäure
- 4028
- 609
- René Riediger
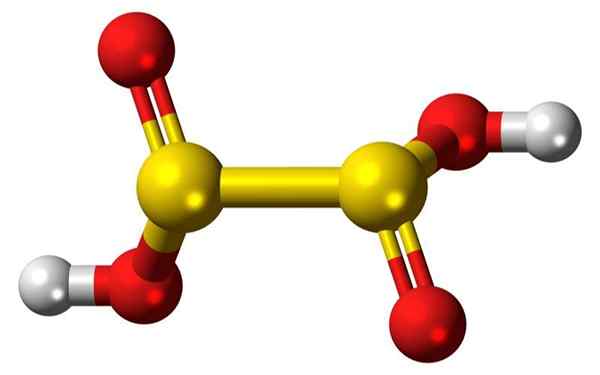
 3D -Balken von Balken und Luftballons eines Hyposulfurous -Säuremoleküls. Quelle: Jynto
3D -Balken von Balken und Luftballons eines Hyposulfurous -Säuremoleküls. Quelle: Jynto Was ist Hyposulfurosäure?
Er Hyposulfurosäure, o dionsäure, es ist unbekannt, rein instabil, es hat keine unabhängige Existenz und wurde in wässriger Lösung nicht nachgewiesen.
Theoretisch wäre es eine relativ schwache Säure, vergleichbar mit Schwefelsäure, H2SO3. Nur ihre Salze sind bekannt, die stabilen Dionitos und leistungsstarke Reduktionsmittel. Das Natriumdionsäuresalz ist Natrium Dionito.
Formeln
Hyposulefurous -Säure -Formeln sind wie folgt:
Dionsäure: H2S2ENTWEDER4
Dionito Anion: S2O42–
Natrium Dionito: na2S2ENTWEDER4
CAS-Nummer: 20196-46-7 Hyposulfurous Säure (oder Dental)
CAS-Nummer: 14844-07-6 Hyposulfurous Säure (oder Dition, Ion)
CAS-Nummer: 7775-14-6 Natrium Dionito (Natrium-Natrium von Ditoring-Säure)
Physikalische und chemische Eigenschaften
- Im Natriumdionito -Salz ist sein Aussehen ein kristalliner, weißer bis grauer Staub mit Flocken aus hellem und schwachem Schwefelzellengrün.
- Das Molekulargewicht von Ditationsäure beträgt 130.132 g/mol. Der Dionito Anion, 128.116 g/mol und das Natrium Dionito, 174.096 g/mol.
- Am Siedepunkt des Natrium Dionito zersetzt es sich, und sein Schmelzpunkt beträgt 52 ° C.
- Die Dichte des Natrium Dionito beträgt 2.38 g/cm³ (wasserfrei), und seine Löslichkeit im Wasser beträgt 18.2 g/100 ml (wasserfrei, 20 ° C).
- Hyposulfuroussäure ist ein Schwefeloxoacid mit der chemischen Formel H2S2ENTWEDER4.
- Schwefeldoxoäakien sind chemische Verbindungen, die Schwefel, Sauerstoff und Wasserstoff enthalten. Einige von ihnen sind jedoch nur für ihre Salze bekannt (z.
Es kann Ihnen dienen: Pyridin: Struktur, Eigenschaften, Verwendung, Toxizität, SyntheseUnter den strukturellen Merkmalen von Oxoaciden haben wir:
- Tetraedrischem Schwefel, wenn er mit Sauerstoff koordiniert wird.
- Sauerstoffatome in Brücke und Klemme.
- Periodinalgruppen.
- S = S -Terminals.
- Ketten von (-s-) n
Schwefelsäure ist die bekannteste Schwefeloxoacid.
- Der Dionito Anion ([s)2ENTWEDER4] 2-) ist ein Oxoanion (ein Ion mit der generischen Formel Axoy z-) des Schwefel.
- Dionito -Ionen erleben sowohl Säure- als auch alkalische Hydrolyse zu Thiosulfat und Bisulfit sowie Sulfit und Sulfid.
- Das Natriumdionsäuresalz ist Natriumdionit (auch als Natriumhydrosulfit bekannt).
- Es kann durch die folgende Reaktion aus Natriumbisulfit erhalten werden:
2 Nahso3 + Zn → Na2SW4 + Zn (OH) ²
Anwendungen
Das Dionitionen wird häufig in Verbindung mit einem komplexen Mittel (z. Analyse (selektive Extraktion).
Dionito ermöglicht die Erhöhung der Eisenlöslichkeit. Dank der starken Affinität des Ionito für bivale und dreiwertige Metallkationen wird es als Chelatmittel verwendet.
Die Zerlegung von Dionito erzeugt verringerte Schwefelarten, die für die Korrosion von Stahl und Edelstahl sehr aggressiv sein können.
Unter den Anwendungen von Natrium Dionito haben wir:
In der Industrie
- Diese Verbindung ist ein wasserlösliches Salz und kann als Reduktionsmittel in wässrigen Lösungen verwendet werden.
- Es wird als solche in einigen industriellen Farbstoffprozessen verwendet, hauptsächlich solche, an denen Schwefelfarbstoffe und Wannenfarbstoffe beteiligt sind, bei denen ein Wasserunlöslicher Wasser in ein Wassersalz mit Wasserlöslichkeitsmodal reduziert werden kann (zum Beispiel der Indigo -Farbstoff) (zum Beispiel der Indigo -Farbstoff).
Kann Ihnen dienen: Säuren: Eigenschaften und Beispiele- Natrium Dionito -Reduktionseigenschaften beseitigen auch überschüssige Farbstoff, Restoxid und unerwünschte Pigmente, wodurch die globale Farbqualität verbessert wird.
- Natrium Dionito kann auch zur Wasserbehandlung, Gasreinigung, Reinigung und Extraktion verwendet werden. Es kann auch in industriellen Prozessen wie einem Sulfonanten Mittel oder einer Natriumquelle verwendet werden.
- Neben der Textilindustrie wird diese Verbindung in Lederindustrien, Lebensmitteln, Polymeren, Fotografie und vielen anderen verwendet. Es wird auch als entfärbtes Mittel bei organischen Reaktionen verwendet.
In biologischen Wissenschaften
- Natrium Dionito wird häufig in Physiologie -Experimenten verwendet, um das Redoxpotential von Lösungen zu verringern.
In geologischen Wissenschaften
- Natrium Dionito wird häufig in Bodenchemie -Experimenten verwendet, um die Eisenmenge zu bestimmen, die nicht in primären Silikatmineralien enthalten ist.
Sicherheit und Risiken
Die Manipulation dieses Elements muss unter extremen Pflegebedingungen durchgeführt werden. Es ist extrem giftig und kann in Verbindung mit Wasser und Luft gefährlich reagieren.
Als nächstes heben wir einige Aspekte hervor.
Luft- und Wasserreaktionen
- Das Natrium Dionito ist ein fester Brennstoff, der sich langsam zersetzt.
- Diese Reaktion erzeugt Wärme, die die Reaktion weiter beschleunigen oder die umgebenden Materialien brennen lassen kann. Wenn die Mischung eingesperrt ist, kann die Zersetzungsreaktion zur Druckunterbrechung des Behälters führen, der stark gebrochen werden kann. Wenn es in der Luft bleibt, oxidiert es langsam und erzeugt toxische Schwefeldioxidgase.
Kann Ihnen dienen: Nitrofuraner: Merkmale, Wirkungsmechanismus und KlassifizierungFeuergefahr
- Das Natrium Dionito ist ein brennbares und brennbares Material. Kann bei Kontakt mit nasser Luft oder Feuchtigkeit entzündet werden. Sie können schnell mit Flare -Effekt verbrennen. Kann kräftig oder explosionsmäßig in Kontakt mit Wasser reagieren.
- Kann beim Erhitzen explosionsartig zerlegt werden oder in ein Feuer verwickelt werden. Kann wieder einschalten, nachdem das Feuer gelöscht wurde. Abfluss kann eine Brand- oder Explosionsgefahr schaffen. Behälter können beim Erhitzen explodieren.
Gesundheitsgefahr
- Wenn das Natrium Dionito in Kontakt mit dem Brand in Kontakt kommt, erzeugt er irritierende, ätzende und/oder giftige Gase. Die Inhalation von Zersetzungsprodukten kann schwere Verletzungen oder Todesfälle verursachen. Der Kontakt mit der Substanz kann schwere Verbrennungen auf Haut und Augen verursachen. Feuerkontrollabfluss kann eine Kontamination verursachen.
Verweise
- Benjah-BMM27 (2006). Ein Ball-and-Stick.Wikipedia.Org.
- Mühlen, b. (2009). Natrium-Dithionit -xt-1992-3d-Balls [Bild] gewonnen von: in: in.Wikipedia.Org.

