Píchric Säure Was ist, Struktur, Synthese, Eigenschaften
- 3407
- 295
- Rieke Scheer
Er Píchric Säure Es ist eine hochnitrado organische chemische Verbindung, deren Name IUPAC 2,4,6-Trinitrofenol beträgt. Seine molekulare Formel ist c6H2(NEIN2)3Oh. Es ist ein sehr saures Phenol und kann als Natriumpikrat, Ammonium oder Kalium gefunden werden; das heißt in seiner ionischen Form c6H2(NEIN2)3AUF EINEN.
Es ist ein fester Geschmack von Bitter und leitet seinen Namen aus dem griechischen Wort "Prikos" ab, was bitter bedeutet. Es wird als nasse gelbe Kristalle gefunden. Seine Austrocknung oder Dehydration ist gefährlich, da sie die instabilen Eigenschaften erhöht, die es explosiv machen.
Píchinsäure wird als Grundlage für die Synthese von dauerhaften gelben Farbstoffen verwendet. Einige Pathologen und Forscher verwenden es in der Fixierung oder Färbung von Gewebeschnitten und anderen immunhistochemischen Prozessen.
Es ist sehr nützlich bei der Entwicklung von pharmazeutischen Produkten. Darüber hinaus wird es zur Ausarbeitung von Spielen oder Spielen und Sprengstoff verwendet. Es wird auch zum Aufzeichnen von Metallen, zur Herstellung farbiger Glas und zur kolorimetrischen Bestimmung biologischer Parameter wie Kreatinin verwendet.
Struktur
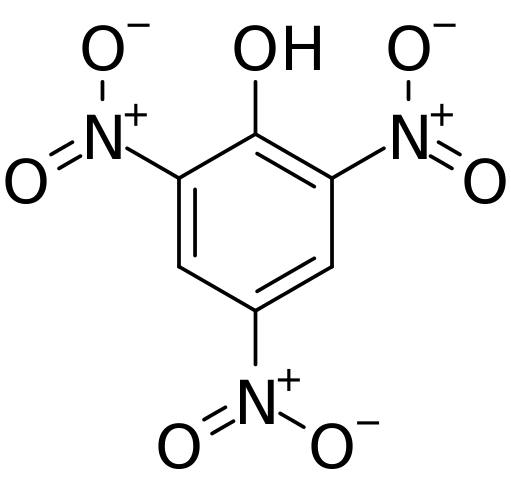
 Struktur und formale Belastungen in Pychorsäure. Quelle: CVF-PS [Public Domain]
Struktur und formale Belastungen in Pychorsäure. Quelle: CVF-PS [Public Domain] Im oberen Bild werden alle Bindungen und die Struktur in sich selbst des Píchric -Säure -Moleküls ausführlicher dargestellt. Es besteht aus einem Phenol mit drei Nitro -Substituenten.
Es ist ersichtlich, dass in Gruppen nicht2 Das Stickstoffatom hat eine positive teilweise Belastung und somit daher nach elektronischer Dichte aus seiner Umgebung. Aber der aromatische Ring zieht auch die Elektronen zu sich selbst und vor den drei Nr2 endet am Ende einen Teil seiner eigenen elektronischen Dichte.
Infolgedessen tendiert der OH -Gruppe Sauerstoff mehr dazu, einen seiner freien elektronischen Kollegen zu teilen, um den vom Ring verursachten elektronischen Mangel zu liefern. Und dabei wird der Link C = O gebildet+-H. Diese positive teilweise Belastung des Sauerstoffs schwächt die O-H-Bindung und Säure steigt; das heißt, es wird als Wasserstoffion freigesetzt, h+.
Säurephenol
Aus diesem Grund ist diese Verbindung eine außergewöhnlich starke Säure (und ein Reagenz), sogar mehr als Essigsäure selbst. Die Verbindung ist jedoch wirklich ein Phenol, dessen Säure die der anderen Phenole übertrifft. wie gerade erwähnt, die Substituenten nicht2.
Kann Ihnen dienen: thermodynamische ProzesseDa es sich um ein Phenol handelt, hat die OH -Gruppe Priorität und leitet die Aufzählung in der Struktur. Die drei nein2 Sie befinden sich in den Kohlenstoffen 2, 4 und 6 des aromatischen Rings in Bezug auf OH. Von hier aus leitet die IUPAC-Nomenklatur für diese Verbindung ab: 2,4,6-Trinitrofenol (TNP).
Wenn die Gruppen nicht wären2, Oder wenn es im Ring eine geringere Anzahl von ihnen gäbe, würde das O-H-Glied weniger schwächen, und daher würde die Verbindung weniger Säure haben.
Kristalline Struktur
Pycrinsäuremoleküle werden so geordnet, dass sie ihre intermolekularen Wechselwirkungen bevorzugen; entweder für die Bildung von Wasserstoffbrücken zwischen OH -Gruppen und nicht zur Bildung2, Dipolo-Dipolo-Kräfte oder elektrostatische Abstoßungen zwischen den armen Elektronenregionen.
Es ist zu erwarten, dass Gruppen dies nicht tun2 Sie stoßen sich gegenseitig ab und Führung in Richtung benachbarter aromatischer Ringe. Ebenso konnten die Ringe aufgrund eines Anstiegs der elektrostatischen Abstoßungen keine übereinander übereinstimmen.
Infolge all dieser Wechselwirkungen gelingt es Píchric Acid, ein dreidimensionales Netzwerk zu bilden, das einen Kristall definiert; deren einheitliche Zelle entspricht einem kristallinen System des ortorrombischen Typs.
Synthese
Anfangs wurde es unter anderem aus natürlichen Verbindungen wie Tierhornderivaten und natürlichen Harzen synthetisiert. Ab 1841 wurde Phenol als Vorläufer der Pikrinsäure verwendet, folgt mehreren Routen oder durch mehrere chemische Eingriffe.
Wie bereits gesagt, ist es eines der saursten Phenole. Um es zu synthetischen.
Die Sulfonierung des wasserfreien Phenols wird durchgeführt, wenn das Phenol mit Rauchschwefelsäure behandelt wird, die durch Sulfonatgruppen auftretende aromatische elektrophylische Substitutionen von H3H, in der Position -orto und -Para in Bezug auf die OH -Gruppe.
Dieses Produkt, 2,4-Pynoldisulfonsäure, der Nitrationsprozess wird durchgeführt, wobei es mit konzentrierter Salpetersäure behandelt wird. Dabei die beiden so Gruppen3H werden durch Nitrogruppen ersetzt, nein2, Und ein drittes tritt in die andere Nitro -Position ein. Die folgende chemische Gleichung zeigt dies:
Kann Ihnen dienen: elastische Materialien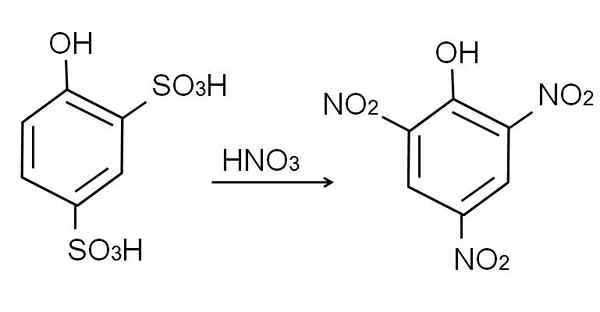 Säurenitration 2,4-Phenoldisulfonic. Quelle: Gabriel Bolívar.
Säurenitration 2,4-Phenoldisulfonic. Quelle: Gabriel Bolívar. Direkte Nitrierung des Fenols
Der Nitrationsprozess des Phenols kann nicht direkt durchgeführt werden, da Ziele mit hohem Molekulargewicht erzeugt werden. Diese Synthesemethode erfordert eine sehr sorgfältige Kontrolle der Temperatur, da sie sehr exotherm ist:
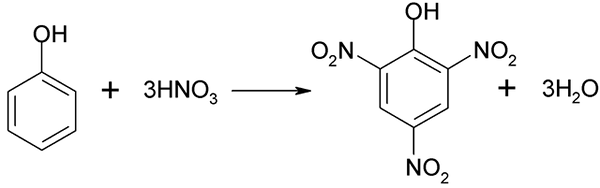 Direkte Nitrierung des Fenols. Quelle: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Direkte Nitrierung des Fenols. Quelle: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Píchinsäure kann bei der Durchführung des direkten Nitrationsprozesses von 2,4-Dinitrofenol mit Salpetersäure erhalten werden.
Eine andere Form der Synthese ist die Behandlung von Benzol mit Salpetersäure und Mercuric -Nitrat.
Physikalische und chemische Eigenschaften
Molekulargewicht
229.104 g/mol.
Aussehen
Gelbe Masse von nassen Kristallen.
Geruch
Es ist Toilette.
Geschmack
Es ist sehr bitter.
Schmelzpunkt
122.5 ° C.
Siedepunkt
300 ° C. Aber beim Schmelzen explodiert es.
Dichte
1,77 g/ml.
Löslichkeit
Es ist eine mäßig wasserlösliche Verbindung. Dies liegt daran, dass Ihre OH -Gruppen und nicht Ihre OH -Gruppen2 Sie können durch Wasserstoffbrücken mit Wassermolekülen interagieren; Obwohl der aromatische Ring hydrophob ist, und deshalb schadet er seine Löslichkeit.
Korrosivität
Pycrinsäure ist im Allgemeinen für Metalle korrosiv, mit Ausnahme von Zinn und Aluminium.
PKA
0,38. Es ist eine starke organische Säure.
Instabilität
Píchinsäure ist durch Besitz von instabilen Eigenschaften gekennzeichnet. Es ist ein Risiko für die Umwelt, es ist instabil, explosiv und giftig.
Es muss gut geschlossen gelagert werden, um Dehydration zu vermeiden. Sie müssen mit seiner wasserfreien Form sehr vorsichtig sein, da sie sehr empfindlich gegenüber Reibung, Schlägen und Wärme reagiert.
Pychralsäure sollte in belüfteten, frischen Stellen gelagert werden, weit weg von oxidierbaren Materialien. Es ist irritierend, Kontakt mit der Haut und der Schleimhäute zu erreichen, es sollte nicht aufgenommen werden und ist für den Körper giftig.
Anwendungen
Píchinsäure wurde im Forschungsbereich, in der Chemie, in der Industrie und im Militärbereich häufig eingesetzt.
Untersuchung
Wenn es als Zell- und Gewebefixiermittel verwendet wird. Es geschieht mit trichromischen Farbmethoden. Nachdem das Stoff mit Formalin eingestellt wurde, wird eine neue Fixierung mit Píchricsäure empfohlen.
Kann Ihnen dienen: Drücken Sie Filter: Eigenschaften, Teile, wie es funktioniert, verwendetAuf diese Weise ist eine intensive und sehr helle Färbung des Gewebes garantiert. Gute Ergebnisse werden mit Basisfarbstoffen erzielt. Vorsichtsmaßnahmen müssen jedoch.
Organische Chemie
-In der organischen Chemie wird es als alkalisches Pikriate verwendet, um verschiedene Substanzen zu identifizieren und zu analysieren.
-Wird in der Metallanalysechemie verwendet.
-In klinischen Labors wird es zur Bestimmung des Serum- und Harnwerte von Kreatinin verwendet.
-Es wurde auch in einigen der Reagenzien für die Analyse der Glukosespiegel verwendet.
In der Industrie
-Auf der Ebene der fotografischen Industrie wurde Píchric Acid als Sensibilisator in fotografischen Emulsionen verwendet. War Teil der Ausarbeitung von Produkten wie Pestiziden, starken Insektiziden unter anderem.
-Píchinsäure wird verwendet. Aus diesen Verbindungen wurden einige Medikamente und Farbstoffe für die Lederindustrie entwickelt.
-Bei der Behandlung von Verbrennungen wie antiseptischen und anderen Erkrankungen wurde Píchric -Säure verwendet, bevor ihre Toxizität nachgewiesen wurde.
-Wichtige Komponente durch seine explosive Natur bei der Ausarbeitung von Spielen und Batterien.
Militäranträge
-Aufgrund der hohen Explosivität von Píchric -Säure wurde es in militärischen Munitionspflanzen eingesetzt.
-Píchric Acid wurde in Artillerie -Projektilen, Pumpen und Minen gepresst und gegossen wurde verwendet.
-Pycrinsäure Ammoniumsalz wurde als Sprengstoff verwendet, ist sehr stark, aber weniger Stabilität als TNT. Für eine Zeit wurde es als Raketentreibstoffkomponente verwendet.
Toxizität
Es wurde nachgewiesen, dass es für den menschlichen Organismus und im Allgemeinen für alle Lebewesen sehr giftig ist.
Es wird empfohlen, seine Inhalation und Aufnahme zu vermeiden, um eine akute orale Toxizität zu haben. Es verursacht auch Mutation bei Mikroorganismen. Es zeigt toxische Wirkungen auf die Tierwelt, bei Säugetieren und im Allgemeinen in der Umwelt.
Verweise
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Purdue Universität. (2004). Pikrinsäurexplosion. Abgerufen von: Chemed.Chem.Purdue.Edu
- « Patricia Benner Biographie, Theorie und andere Beiträge
- Maguey Was ist, Eigenschaften, Lebensraum, Reproduktion »

