Sulfanilsäurstruktur, Eigenschaften, Synthese, verwendet
- 2018
- 280
- Rieke Scheer
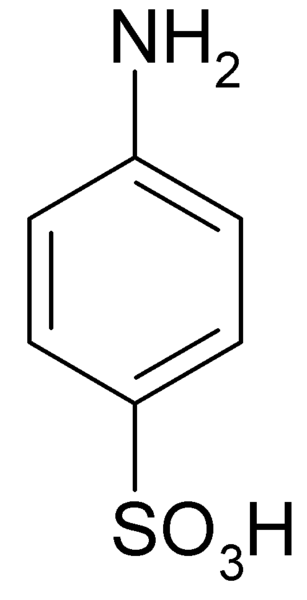
Er Sulfanilsäure Es ist eine kristalline Verbindung, deren Molekül durch einen Benzolring gebildet wird, zu dem eine Basisgruppe gleichzeitig vereint ist (-nh2) und eine Säuregruppe (-so3H). Seine chemische Formel ist NH2C6H4SW3H.
Es ist auch als 4-Aminobenosulfonsäure bekannt. Es wird durch Sulfonation von Anilin in der Position für hergestellt. Seine Kristalle sind weiße oder weiße Gebäude. Sein Verhalten ist dem eines Salzes ähnlicher als dem einer organischen Verbindung mit NH -Gruppen2 tragen3H. Daher ist es in den meisten organischen Lösungsmitteln unlöslich.
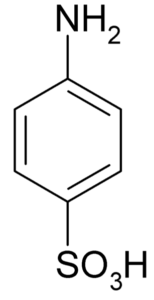 Molekülformel von Sulfanilsäure oder 4-Amynbenzeulfonsäure. Klaus Hoffmeier [Public Domain]. Quelle: Wikipedia als uns
Molekülformel von Sulfanilsäure oder 4-Amynbenzeulfonsäure. Klaus Hoffmeier [Public Domain]. Quelle: Wikipedia als uns Eine seiner Hauptanwendungen liegt in der Synthese von Farbstoffen, da sie leicht eine Diazokomponsierung bildet, die Rohstoff für diese Anwendung ist.
Sowohl Sulfanylsäure als auch ihre Derivate wurden als antibakterielle Mittel verwendet. Es wird in der Synthese von mukolytischen Verbindungen verwendet.
Es wird auch in der Papierindustrie und in Formeln für Gravuren oder Lithografien verwendet. Es ist Teil von Harzen, die in Betonmischungen oder Mörsern verwendet werden, damit sie ihre Fluidität für lange Zeit aufrechterhalten können, ohne die endgültige Zeit zu beeinflussen.
Es ist ein xenobiotischer Metaboliten, dies bedeutet, dass es nicht von Lebewesen hergestellt wird. Es ist irritierende Haut, Augen und Schleim. Darüber hinaus können Sie die Umgebung kontaminieren.
[TOC]
Struktur
Sulfanilsäure hat weiße Kristalle, die durch ortorrombische oder monokline Blätter gebildet werden. Sein Monohydrat kristallisiert in Wasser in Form orthorrombischer Blätter. Wenn die Kristallisation sehr langsam erfolgt, kristallisiert Dihydrat. Das Monohydrat wird wasserfrei, wenn es ungefähr 100 ºC ist.
Nomenklatur
- Sulfanilsäure.
- P-Amynobencenosulfonsäure.
- 4-Amybonzefonsäure.
Eigenschaften
Körperlicher Status
Weißer oder weißer kristalline Feststoff.
Molekulargewicht
173.19 g/mol.
Schmelzpunkt
Es bricht auf etwa 288 ° C ab, ohne zu schmelzen. Es wird auch> 320 ºC gemeldet.
Dichte
1,49 g/cm3
Löslichkeit
Fast unlöslich im Wasser: 10,68 g/l bei 20 ºC.
Unlöslich in Ethanol, Benzol und Äther. Etwas löslich in heißem Methanol.
Löslich in wässrigen Basislösungen. Unlöslich in wässrigen Mineralsäurelösungen. Löslich in konzentrierter Salzsäure.
Chemische Eigenschaften
Seine Eigenschaften unterscheiden. Dies liegt daran, dass seine Struktur die Gruppen -nh enthält3+ Und so3-, Was gibt ihm Eigenschaften des Dipolionen.
Kann Ihnen dienen: übersättigte LösungEs enthält eine Säuregruppe und eine Grundgruppe in entgegengesetzten Polen desselben Moleküls. Aber das Wasserstoffionen ist mit Stickstoff anstelle von Sauerstoff verbunden, weil die Gruppe -NH2 Es ist eine stärkere Basis als die Gruppe -so3-.
Da es sich um ein Dipol -Ion handelt.
Sulfanilsäure ist in alkalischer Lösung löslich, weil OH -Hydroxidionion-, Ein stark grundlegender Fall zu sein, beginnt ein Wasserstoffionen (h+) der schwachen Grundgruppe -nh2, Bildung des P-Aminobencenosulfonat-Ions, das wasserlöslich ist.
In der Säurelösung ändert sich die Sulfanylsäurestruktur nicht, daher bleibt sie unlöslich.
Andere Eigenschaften
Wenn er auf seine Zersetzung erhitzt wird.
Die Sulfanylsäure -Exposition kann zu Symptomen wie Hautreizungen, Augen und Schleimhäuten führen. Es ist eine ätzende Verbindung.
Synthese
Es wird hergestellt, indem Anilin mit Schwefelsäure (h) reagiert wird2SW4) bei hohen Temperaturen. Zunächst wird das anilinische Säure-Sulfat-Salz gebildet, das beim Erhitzen bei 180 bis 200 ° C neu organisiert wird, um den Ring in Position zu bilden, da es das stabilste Produkt ist.
Um es mit einem hohen Grad an Reinheit vorzubereiten, wird die Sulfonierung einer Mischung aus Anilin und Sulphholano mit H durchgeführt2SW4 bei 180-190 ºC.
Anwendungen
In der Malvorlagenindustrie
Sulfanylsäure wird in der Synthese oder Herstellung mehrerer Farbstoffe wie Methylorange und Tartrazin verwendet. Dafür ist es diazotisiert und erzeugt diazotisierte Sulfanylsäure.
Es ist wichtig hervorzuheben, dass Tartrazin als Färbung in Lebensmitteln verwendet wurde. Aber nach der Einnahme erzeugt es bestimmte Metaboliten im menschlichen Organismus, einschließlich Sulfanylsäure, die für die Bildung reaktiver Sauerstoffspezies verantwortlich sind. Diese können Nieren- (Nieren) oder Lebergewebe (Leber) beeinflussen.
 Karamellen mit gelber Farbstoff. David Adam Kess [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons
Karamellen mit gelber Farbstoff. David Adam Kess [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons In der analytischen Chemie
Es wird als Reagenz zur Bestimmung mehrerer chemischer Verbindungen, einschließlich Nitriten, verwendet.
In der Medizin als antibakterielles Mittel
Sulfanylamid, der aus Sulfanylsäure stammt, ist in der pharmazeutischen Industrie angewendet.
In den menschlichen Körperbakterien verwechseln Sie es mit P-Aminobenzoesäure, der ein essentieller Metabolit ist. Diese Substitution führt dazu, dass Bakterien nicht reproduziert und sterben.
Kann Ihnen dienen: Wasserstoff: Geschichte, Struktur, Eigenschaften und Verwendung Bakterium. Raman Oza Bild. Quelle: Pixabay
Bakterium. Raman Oza Bild. Quelle: Pixabay Eine andere aus Sulfanylsäure, die durch Kondensation mit anderen Verbindungen erhalten wurde, hat ebenfalls antibakterielle Eigenschaften, die auf seiner Fähigkeit basieren, Folsäure zu verdrängen (Mitglied des Vitamin -Komplexes B).
Diese Verbindung kann oral, intravenös oder äußerlich in eine Salbe aufgebracht werden.
In der Medizin als mukolytisches Mittel
Es wurde ein Sulfanylsäure -Derivat mit mukolytischen Aktivität verwendet. Dies ist so.
Die Verbindung kann verwendet werden, um Schleim zu erzeugen, das durch ein Gewebe aufgrund pathologischer Bedingungen erzeugt wird. Zum Beispiel die Stauung des Atmungssystems oder dessen aus dem Vaginaltrakt unter anderem.
In Bezug. Es ist eine Behandlung, die für das Mensch oder Säugetiere anwendbar ist. Es ist eine stärkere Verbindung als Cysteinbasis.
 Anwendung von Nasenentropfen für Kälte. Thorsten Frenzel Bild. Quelle: Pixabay
Anwendung von Nasenentropfen für Kälte. Thorsten Frenzel Bild. Quelle: Pixabay Es wird auch im Labor verwendet, wenn es erwünscht ist, die Viskosität biologischer Flüssigkeiten zu verringern, um analytische Bestimmungen zu erleichtern.
In Bioanalyse Laboratorien
Diazotisierte Sulfanylsäure (ein Derivat, das durch Reaktion von Sulfanylsäure mit Natriumnitrit hergestellt wird) wird bei der Bestimmung von Bilirubin verwendet.
Bilirubin ist ein gelbes Pigment in Galle. Der Überschuss an Blutbilirubin ist eine Folge von Lebererkrankungen, hämatologischen Störungen (oder Blut) oder Störungen im Gallentrakt.
Um die Menge an Blutbilirubin zu messen, wird die aus Sulfanylsäure mit Bilirubin abgeleitete Dialyse zur Bildung des Azobilirubin -Komplexes reagiert, dessen Farbe die Intensität mit einem Colorimeter oder einem Spektrophotometer gemessen wird. Auf diese Weise wird der Blut -Bilirubin -Gehalt im Blut bestimmt.
In der Papierindustrie
Mit Sulfanilsäure können Sie ein Papierpolieren synthetisieren, dh eine Verbindung, die optische Helligkeit oder weißes Aussehen liefert, da die gelbe Farbe von natürlichen oder nicht gesperrten Papier neutralisiert wird.
 White Paper Notebook. Quelle: Pexels
White Paper Notebook. Quelle: Pexels Es hat den Vorteil gegenüber anderen Verbindungen, da es in relativ hohen Konzentrationen verwendet werden kann.
Kann Ihnen dienen: AmmoniumsulfatDas Ergebnis zeigt.
Es ist sehr löslich im Wasser und ermöglicht es, in konzentrierteren Lösungen zu verwenden. Es kann in jeder Art von Papier verwendet werden, einschließlich des Papiers, das mit gemahlenem Holzzellstoff, Sulfitzellstoff oder einem anderen Prozess erzeugt wird.
In Eindrücken, Gravuren oder Lithographien
Sulfanilsäure fungiert als Ansäuerung in konzentrierten Lösungen für die Lithographie, ohne die Probleme anderer Säuren wie Phosphor zu zeigen, weniger toxisch und weniger verschmutzt als letztere als letztere.
In Baumaterialien
Wässrige Melamin-Formaldehyd-Harzlösungen, die mit Sulfanylsäure modifiziert wurden, wurden spezifisch (Beton), Mörtel oder Zementpaste getestet. Ziel war es, den Wassergehalt zu reduzieren und die Abnahme der Fluidität der Mischung mit dem Zeitverlauf zu verhindern, ohne dass die Abstellungszeit abnimmt.
Der mit diesen Lösungen vorbereitete Beton oder Mörtel ist im Sommer sehr effektiv, wenn die Abnahme der Sprachkenntnisse im Laufe der Zeit ein Problem darstellt.
Bei diesen Lösungen kann die Zementzusammensetzung leicht in Formen oder ähnliches entlassen werden.
 Betonentladung. Igor Image Ovsyannykov. Quelle: Pixabay
Betonentladung. Igor Image Ovsyannykov. Quelle: Pixabay Verweise
- Windholz, m. et al. (Herausgeber) (1983). Der Merck Index. Eine Enzyklopädie von Chemikalien, Drarugs und Biologicals. Zehnte Ausgabe. Merck & co., Inc.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 2. Vierte Edition. John Wiley & Söhne.
- Nationalbibliothek für Medizin. (2019). Sulfanilsäure. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Urist, h. und Martin, G.J. (1950). Sulfanilsäurederivate. US -Patent Nr. 2.504.471. Abtretungen an die National Drug Company. 18. April 1950.
- Villaume, Frederick G. (1964). Brightcar -Zusammensetzung für Papier, die aus metanilischen und Sulfanilsäure entbunden sind. US -Patent Nr. 3,132,106. 5. Mai 1964.
- Martin, Tellis a. und essen, William T. (1979). Benzoesäure Derivat und Benzenesulfonsäure mukolytisch. US -Patent Nr. 4,132.802. 2. Januar 1979.
- Druker, l.J. und Kincaid, r.B. (1979). Lithografische Brunnenkonzentrat. US -Patent Nr. 4,150.996. 24. April 1979.
- Schull, Bruce C. (1983). Bilirubin -Assay. US -Patent Nr. 4,404.286. 13. September 1983.
- Uchida, j. et al. (2001). Prozess zur Herstellung einer wässrigen Lösung von Sulfanilsäure-modifiziertem Melamin-Formaldehydharz und einer Zementzementzusammensetzung. US -Patent Nr. 6,214.965 B1. 10. April 2001.
- Corradini, m.G. (2019). Band 1. In Enzyklopädie der Lebensmittelchemie. Von Scientedirect erholt.com.
- « Galinsäurestruktur, Eigenschaften, erhalten, verwendet, verwendet
- Schwarz durch Hintergrund, Entwicklung, Maßnahmen »

