Sulfhydric Säure (H2S) Struktur, Eigenschaften, Verwendungszwecke, Wichtigkeit
- 2694
- 669
- René Riediger
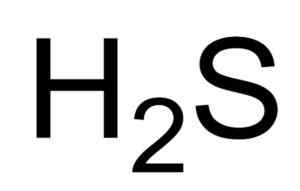
Er Schwefeläure o Schwefelwasserstoff ist ein Gas, das durch die Vereinigung eines Schwefelatoms und zwei Wasserstoffatome (H) gebildet wird. Seine chemische Formel ist h2S. Es ist auch als Sulfidgas bekannt. Es ist ein farbloses Gas, dessen Geruch in faulen Eiern ersichtlich wird.
Es ist in Vulkanen und schwefeligen heißen Federn in Erdgas und Rohöl vorhanden. Es wird auch während einer anaeroben (ohne Sauerstoff-) Zersetzung von pflanzlichen und tierischen organischen Substanzen gebildet. Es kommt natürlich im Körper von Säugetieren auf.
 Chemische Formel von Sulfhydsäure oder Wasserstoffsulfid. Saranphong Yimklan [Public Domain]. Quelle: Wikimedia Commons.
Chemische Formel von Sulfhydsäure oder Wasserstoffsulfid. Saranphong Yimklan [Public Domain]. Quelle: Wikimedia Commons. Die wässrigen Lösungen von H2S sind korrosiv für Metalle wie Stahl. Die h2S ist eine reduzierende Verbindung, die bei Reaktion mit dem SO2 , Es oxidiert elementarer Schwefel und reduziert sich gleich2 Auch Schwefel.
Obwohl es sich um eine hochgiftige und tödliche Verbindung für Menschen und Tiere handelt, wurde ihre Bedeutung für einige Jahre in einer Reihe wichtiger Prozesse im Körper untersucht.
Reguliert eine Reihe von Mechanismen im Zusammenhang mit der Erzeugung neuer Blutgefäße und der Funktionsweise des Herzens.
Schützen Sie Neuronen und haben an seine Handlung gegen Krankheiten wie Parkinson und Alzheimer gedacht.
Wegen seiner chemischen Reduzierung kann oxidierende Spezies bekämpfen und so gegen Zellalterung wirken. Aus diesen Gründen wird die Möglichkeit, Medikamente zu produzieren.
Dies würde zur Behandlung von Pathologien wie Ischämie, Diabetes und neurodegenerativen Erkrankungen dienen. Ihr Handlungsmechanismus und ihre Sicherheit müssen jedoch weiterhin ausführlich untersucht werden.
[TOC]
Struktur
Die H -Molekula2S ist analog zu dem des Wassers, das heißt, sie ähneln ihrer Form, weil sich Hydrogene befinden, die einen Winkel mit Schwefel bilden.
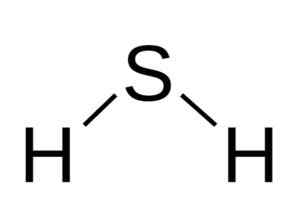 Winkelstruktur des Sulfidsäuremoleküls H2S. Bangin [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons.
Winkelstruktur des Sulfidsäuremoleküls H2S. Bangin [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons. Schwefel in h2S hat die folgende elektronische Konfiguration:
1s2, 2s2 2 p6, 3s2 3p6,
Nehmen Sie dann ein Elektron jedes Wasserstoffs, um seine Valenzschicht zu vervollständigen.
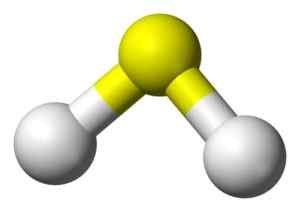 3D -Struktur von Sulfidsäure. Gelb: Schwefel. Weiß: Wasserstoff. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
3D -Struktur von Sulfidsäure. Gelb: Schwefel. Weiß: Wasserstoff. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
- Schwefeläure
- Schwefelwasserstoff
- Schwefelhydrid.
Physikalische Eigenschaften
Körperlicher Status
Farbloses Gas von sehr unangenehmem Geruch.
Molekulargewicht
34,08 g/mol.
Schmelzpunkt
-85,60 ºC.
Siedepunkt
-60,75 ºC.
Dichte
1,1906 g/l.
Löslichkeit
Mäßig wasserlöslich: 2,77 Volumina in 1 Wasser bei 20 ° C. Es kann aus der wässrigen Lösung vollständig vertrieben werden, indem sie sie zum Kochen einreicht.
Chemische Eigenschaften
In wässriger Lösung
Wenn Wasserstoffsulfid in wässriger Lösung ist, wird der Name der Sulfhydsäure zugeordnet. Es ist eine schwache Säure. Es hat zwei ionisierbare Protonen:
H2S + h2Oder ⇔ h3ENTWEDER+ + HS-, KA1 = 8,9 x 10-8
HS- + H2Oder ⇔ h3ENTWEDER+ + S2-, KA2 ∼ 10-14
Das erste Proton ist leicht ionisiert, wie aus seiner ersten Ionisationskonstante abgeleitet werden kann. Der zweite Proton ist sehr wenig ionisiert, aber die Lösungen von H2S enthält etwas von den Schwefelanionen s2-.
Wenn die H -Lösung2S ist der Luft ausgesetzt, das o2 Oxida zu Sulfidanion und Schwefel schlägt aus:
Kann Ihnen dienen: Oxide2 s2- + 4 h+ + ENTWEDER2 → 2 h2O + 2 s0↓ (1)
In Gegenwart von Chlor CL2, Bromo BR2 und Jod i2 Der entsprechende Wasserstoff und Schwefel wird gebildet:
H2S + br2 → 2 HBR + S0↓ (2)
Die wässrigen Lösungen von H2S sind ätzend, erzeugen Stressrisse mit Sulfid in hohen harten Stählen. Korrosionsprodukte sind Eisen- und Wasserstoffsulfid.
Sauerstoffreaktion
Die h2S reagiert mit dem Sauerstoff der Luft und die folgenden Reaktionen können auftreten:
2 h2S + 3 o2 → 2 h2O + 2 so2 (3)
2 h2S + o2 → 2 h2O + 2 s0↓ (4)
Reaktion mit Metallen
Es reagiert mit verschiedenen Metallen, die sich in Wasserstoff bewegen und Metallsulfid bilden:
H2S + PB → PBS + H2↑ (5)
Reaktion mit Schwefeldioxid
In den vulkanischen Gasen sind die H vorhanden2S und das so2, die miteinander reagieren und fester Schwefel gebildet wird:
H2S + so2 → 2 h2O + 3 s0↓ (6)
Zersetzung mit Temperatur
Wasserstoffsulfid ist nicht sehr stabil, es kann durch Erhitzen leicht gebrochen werden:
H2S → h2↑ + s0↓ (7)
Ort in der Natur
Dieses Gas ist natürlich in sulfidischem oder schwefelförmigen heißen Federn, in Vulkangasen, in Rohöl und Erdgas zu finden.
 Schwefelwasser Manantial. Николай максирович [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons.
Schwefelwasser Manantial. Николай максирович [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons. Wenn Öl (oder Gas) signifikante Spuren von H enthält2S soll "sauer" sein, im Gegensatz zu "süß", wenn es es nicht enthält.
Kleine Mengen von h2S in Öl oder Gas sind wirtschaftlich schädlich, da eine Waschanlage installiert werden muss, um sie zu entfernen, um Korrosion zu verhindern, und um Restgas für den Haushalt als Kraftstoff zu schützen.
Es tritt auf, wenn die organische Substanz, die Schwefel enthält.
 H Emissionen2S (bläulich grüne Farbe) an der Küste von Namibia, fotografiert von der NASA. Diese Emissionen stammen aus organischen Abfällen. Das Erdobservatorium der NASA [CC von 2.0 (https: // creativecommons.Org/lizenzen/by/2.0)]]. Quelle: Wikimedia Commons.
H Emissionen2S (bläulich grüne Farbe) an der Küste von Namibia, fotografiert von der NASA. Diese Emissionen stammen aus organischen Abfällen. Das Erdobservatorium der NASA [CC von 2.0 (https: // creativecommons.Org/lizenzen/by/2.0)]]. Quelle: Wikimedia Commons. Die im Mund und im Magen -Darm -Trakt vorhandenen Bakterien produzieren sie aus den abbaubaren Materialien, die Gemüse oder tierische Proteine enthalten.
Sein charakteristischer Geruch verursacht seine Anwesenheit in faulen Eiern.
Die h2S Es tritt auch bei bestimmten industriellen Aktivitäten auf, wie beispielsweise in Ölraffinerien, Koksöfen, Papierfabriken, Sie hätten und in der Lebensmittelverarbeitung.
Synthese im Körper von Säugetieren
Die h2S endogen kann in Säugetiergeweben auftreten, unter diesen Menschen auf zwei Wegen, eine enzymatische und nicht enzymatische Wege.
Der nicht -enzymatische Weg besteht darin, elementare Schwefel zu verringern0 zu h2S durch Glukoseoxidation:
2 c6H12ENTWEDER6 (Glukose) + 6 s0 (Schwefel) + 3 h2O → 3 c3H6ENTWEDER3 + 6 h2S + 3 co2 (8)
Kann Ihnen dienen: Chlor: Geschichte, Eigenschaften, Struktur, Risiken, verwendetDer enzymatische Pfad besteht aus H H2S aus dem L-Cystein, einer Aminosäure, die vom Körper synthetisiert wurde. Der Prozess ist durch mehrere Enzyme versichert, wie z. B. Cystation.
 Sulfhydsäure wurde im Gehirn von Kühen gefunden. Autor: Arttower. Quelle: Pixabay.
Sulfhydsäure wurde im Gehirn von Kühen gefunden. Autor: Arttower. Quelle: Pixabay. Im Labor oder industriell erhalten
Wasserstoffgas (H)2) und das Schwefelelement (en) reagiert nicht auf normale Umwelttemperaturen, aber darüber beginnen sie zu kombinieren, wobei die optimale Temperatur 310 ° C beträgt.
Der Prozess ist dennoch zu langsam, daher werden andere Methoden verwendet, um ihn zu erhalten, darunter die folgenden.
Metallsulfide (wie Eisensulfid) reagieren mit Säuren (wie Hydrochlora) in verdünnter Lösung.
FES + 2 HCl → FECL2 + H2S ↑ (9)
Auf diese Weise wird das Gas erhalten2S, die angesichts seiner Toxizität sicher gesammelt werden müssen.
Industrielle Verwendung von H2S Schwefel produzieren
Lagerung und Transport in großen Mengen von H2S, die sich vom Erdgas durch Waschen mit Aminen trennt, ist schwierig, daher wird der Claus -Prozess verwendet, um es in Schwefel zu verwandeln.
 In den Ölraffinerien wird das H getrennt2Erdgas durch Waschen mit Aminen und dann wird Schwefel. Autor: Satyaprem. Quelle: Pixabay.
In den Ölraffinerien wird das H getrennt2Erdgas durch Waschen mit Aminen und dann wird Schwefel. Autor: Satyaprem. Quelle: Pixabay. In diesem Prozess treten zwei Reaktionen auf. Im ersten der h2S reagiert mit Sauerstoff, um dies zu geben2, Wie oben erwähnt (siehe Reaktion 3).
Die zweite ist eine Reaktion, die durch Eisenoxid katalysiert wird, wo das so ist2 ist reduziert und h2S oxidiert und die beiden produzieren Schwefel S (siehe Reaktion 6).
Auf diese Weise wird Schwefel erhalten, der leicht aufbewahrt und transportiert und mehreren Verwendungen zugeordnet werden kann.
Nützlichkeit oder Bedeutung von H2S endogen im Organismus
Die h2S Endogen ist derjenige, der im Organismus als Teil des normalen Stoffwechsels beim Menschen, Säugetieren und anderen Lebewesen auf natürliche Weise auftritt.
Trotz des langen Rufs, ein giftiges und giftiges Gas im Zusammenhang mit der Zersetzung organischer Substanz zu sein2S Endogen ist ein wichtiger Regulator bestimmter Mechanismen und Prozesse im Leben.
Die h2S präsentiert eine hohe Lipofilität oder Affinität zu Fetten, so dass sie die Zellmembranen leicht überschreitet und alle Zellenarten durchdringt.
Herz-Kreislauf-System
Bei Säugetieren fördert oder reguliert Sulfidsäure eine Reihe von Signalen, die den Stoffwechsel, die Herzfunktion und das Überleben von Zellen regulieren.
Es wirkt starke Wirkung auf das Herz, Blutgefäße und zirkulierende Blutelemente aus. Moduliert den Zellstoffwechsel und die Mitochondrienfunktion.
Verteidigt die Nieren des durch Ischämie verursachten Schäden.
Magen-Darm-System
Spielen eine wichtige Rolle als Schutzfaktor gegen Schäden an der Magenschleimhaut. Es wird schätzungsweise ein wichtiger Vermittler der Magen -Darm -Motilität ist.
Es ist wahrscheinlich, dass es an der Kontrolle der Insulinsekretion beteiligt ist.
Zentrales Nervensystem
Es wirkt auch in wichtigen Funktionen des Zentralnervensystems und schützt oxidative Stressneuronen.
 Neuronen werden durch H geschützt2S endogen. Autor: Gerd Altmann. Quelle: Pixabay.
Neuronen werden durch H geschützt2S endogen. Autor: Gerd Altmann. Quelle: Pixabay. Es wird geschätzt, dass es vor neurodegenerativen Erkrankungen wie Parkinsons Parkinson, Alzheimer und Hunginton -Krankheit schützen kann.
Vision Organ
Schützen Sie Photorezeptorzellen vor der durch Licht induzierten Netzhautdegeneration.
Es kann Ihnen dienen: Lithiumcarbonat (LI2CO3): Struktur, Eigenschaften, verwendetGegen das Altern
Die h2S, eine reduzierende Art zu sein, kann von einer Vielzahl von Oxidationsmitteln konsumiert werden, die im Körper zirkulieren. Kampf oxidierende Spezies wie reaktive Sauerstoffspezies und reaktive Stickstoffspezies im Körper.
Begrenzen Sie die Reaktionen von freien Radikalen durch die Aktivierung von antioxidativen Enzymen, die vor den Auswirkungen des Alterns schützen.
Heilungspotential von H2S exogen geliefert
Die Bioverfügbarkeit von H2S endogene Abhängig von bestimmten Enzymen, die an der Biosynthese von Cystein bei Säugetieren beteiligt sind.
Einige Studien legen nahe, dass ein drogener Therapiespender Don2S könnte für bestimmte Pathologien von Vorteil sein.
Zum Beispiel könnte es bei Diabetikern nützlich sein, da beobachtet wurde2S exogen.
Die h2S stellte die Angiogenese oder Bildung von Blutgefäßen exogen, sodass sie zur Behandlung chronischer Ischämiekrankheiten dienen können.
Medikamente werden entwickelt, die H freigeben können2S langsam in der Lage sein, vorteilhaft über verschiedene Krankheiten handeln zu können. Die Wirksamkeit, Sicherheit und Mechanismen ihrer Aktion müssen jedoch noch untersucht werden.
Risiken
Die h2S ist ein tödliches Gift, wenn es rein oder sogar 1 Teil Gas in 200 Teilen Luft inhaliert wird. Vögel sind sehr empfindlich gegenüber H2S und sterben sogar in Verdünnung von 1 in 1500 Teilen Luft.
 Sulfidsäure oder Wasserstoffsulfid H2S ist ein mächtiges Gift. Autor: Openicons. Quelle: Pixabay.
Sulfidsäure oder Wasserstoffsulfid H2S ist ein mächtiges Gift. Autor: Openicons. Quelle: Pixabay. Die h2S ist ein starker Inhibitor bestimmter Enzyme und oxidativer Phosphorylierungsprozesse, was zum Ersticken von Zellen führt. Die meisten Menschen nehmen es in Konzentrationen von mehr als 5 ppb olfitorisch wahr (Teile pro Milliarde). Die Konzentrationen von 20-50 ppm (Teile pro Million) sind für die Augen und den Atemweg irritieren.
Ein Einatmen von 100-250 ppm für einige Minuten kann mangelnde Koordination, Gedächtnisstörungen und motorische Störungen erzeugen. Wenn die Konzentration etwa 150-200 ppm beträgt2S. Wenn eine 500 ppm -Konzentration 30 Minuten eingeatmet wird, können Lungenödeme und Lungenentzündung erzeugt werden.
Konzentrationen von mehr als 600 ppm können innerhalb der ersten 30 Minuten tödlich sein, da das Atmungssystem gelähmt ist. Und 800 ppm ist die Konzentration, die für den Menschen sofort tödlich ist.
Daher sollte vermieden werden, dass es Flüchtlinge gibt2S in Laboratorien, lokal oder überall oder Situation.
Es ist wichtig zu alarmieren, dass viele Todesfälle auftreten, weil Menschen in Räume eintreten,2S, sterben sie auch.
Es ist ein brennbares Gas.
Verweise
- Panthi, s. et al. (2016). Physiologische Bedeutung von Wasserstoffsulfid: aufstrebender POTNT -Neuroprotektor und Neuromodulator. Oxidationsmedizin und zelluläre Langlebigkeit. Volumen 2016. Artikel ID 9049782. Hyndawi erholte sich.com.
- SHEFA, u. et al. (2018). Antioxidans- und Zellsignalfunktionen von Schwefelwasserstoff im Zentralnervensystem. Oxidationsmedizin und zelluläre Langlebigkeit. Volumen 2018. Artikel ID 1873962. Hyndawi erholte sich.com.
- Tabassum, r. et al. (2020). Therapeutische Bedeutung von Wasserstoffsulfid bei alterassoziierten neurodegenerativen Erkrankungen. Neural Regen Res 2020; 15: 653-662. NRRONline wiederhergestellt.Org.
- Martelli, a. et al. (2010). Schwefelwasserstoff: Neue Möglichkeit zur Entdeckung von Arzneimitteln. Arzneimittelforschungsüberprüfungen. Band 32, Ausgabe 6. Aus der Online -Bibliothek abgerufen.Wiley.com.
- Wang, m.-J. et al. (2010). Mechanismen der Angiogese: Rolle von Schwefelwasserstoffsulfid. Klinische und experimentelle Pharmakologie und Physiologie (2010) 37, 764-771. Aus der Online -Bibliothek abgerufen.Wiley.com.
- Dalefield, r. (2017). Rauch und andere inhalierte Toxikon. Schwefelwasserstoff. In Veterinärtoxikologie für Australien und Neuseeland. Von Scientedirect erholt.com.
- Selley, R.C. und Sonnenberg, s.ZU. (2015). Die physikalischen und chemischen Eigenschaften von Erdöl. Schwefelwasserstoff. In Elementen der Erdölgeologie (dritte Ausgabe). Von Scientedirect erholt.com.
- Hocking, m.B. (2005). Schwefel und Schwefelsäure. CLAUS -Prozessumwandlung von Schwefelwasserstoff in Schwefel in Schwefel. In Handbook of Chemical Technology und Pollution Control (dritte Ausgabe). Von Scientedirect erholt.com.
- Lefer, d.J. (2008). Mögliche Bedeutung von Veränderungen des Schwefelwasserstoffsulfids (H)2S) Bioverfügbarkeit bei Diabetes. British Journal of Pharmacology (2008) 155, 617-619. Von BPSPubs abgerufen.Online -Bibliothek.Wiley.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Schwefelwasserstoff. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung.
- Port, j.ZU. und ibarz, j. (1965). Moderne allgemeine Chemie. 7. Ausgabe. Marín Editorial, s.ZU.
- « Sozialistische Bildungsherkunft, Merkmale, Prinzipien, Beispiele
- Neoklassische Theatergeschichte, Eigenschaften, Vertreter, Werke »

