Sulfáminsäurestruktur, Eigenschaften, Synthese, verwendet
- 3960
- 406
- Rieke Scheer
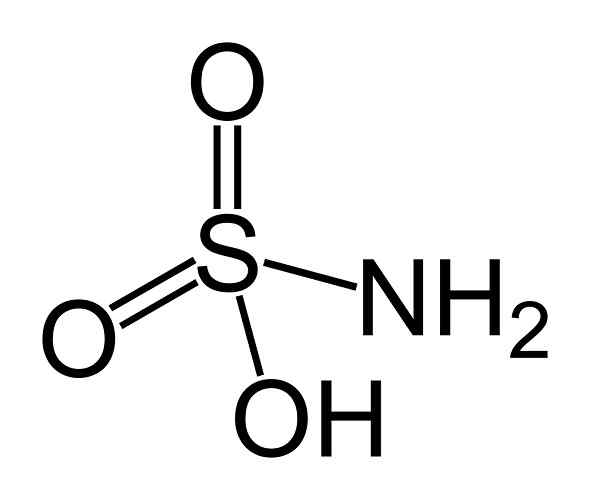
Er Sulfaminsäure Es handelt2) und doppelte Bindung zu zwei Sauerstoffatomen (o). Es ist ein weißer kristalline Feststoff. Seine chemische Formel ist NH2SW3H. Es ist auch als Aminosulfonsäure, Amidosulfonsäure, Amidosulfursäure und Sulfamidinsäure bekannt.
Sulfáminsäure ist eine starke Säure. Sie können mit Metallen, Metall und Carbonatoxiden reagieren. Seine Salze sind im Allgemeinen in Wasser löslich, daher ist es ein guter Entferner von Inlays in Prozessausrüstung. Es wird häufig in Zuckermühlen verwendet, um Carbonatinlays in Verdampfer zu reinigen.
 Sulfáminsäurestruktur. Benjah-BMM27 [Public Domain]. Quelle: Wikipedia Commons.
Sulfáminsäurestruktur. Benjah-BMM27 [Public Domain]. Quelle: Wikipedia Commons. Sulfáminsäure ist ein Nitrit -Reduzierer (nein2-) und diese chemische Eigenschaft wird in mehreren Anwendungen verwendet, wie in der Farbstoffindustrie und der Nitritesanalyse.
Es wird beim Lederbräunen und beim Bleichen der Zellstoff für die Papierherstellung verwendet. In der Tat ist es eine Verunreinigung von Lebensmitteln, da es häufig in den Papieren und Karten vorkommt, mit denen die Lebensmittelgeschäfte einpackt werden.
Es wird auch in Metallelektrode als Labormuster verwendet und eines seiner Derivate ist ein sehr wirksames Herbizid.
[TOC]
Struktur
Sulfaminsäure kristallisiert in Form von bipiramidalen Ortorrombuskristallen. Formen Sie kompakte Prismen und Blätter, wenn sie von kalter Lösung kristallisiert, sowie Rhombusblätter, wenn es eine heiße wässrige Lösung macht.
Nomenklatur
- Sulfaminsäure
- Aminosulfonsäure
- Amidosulfonsäure
- Amidosulfursäure
- Sulfami -Säure
Eigenschaften
Körperlicher Status
Weißer kristalline Feststoff.
Molekulargewicht
97,1 g/mol.
Schmelzpunkt
205 ° C, zersetzt sich bei 209 ºC.
Dichte
2,15 g/cm3
Löslichkeit
In Wasser löslich:
- 12,8% bis 0 ºC
- 17,57% bei 20 ° C
- 22,77% bei 40 ° C
Kaum löslich in Methanol, leicht löslich in Aceton, unlöslich im Äther.
Frei löslich in Stickstoffbasen und organischen Lösungsmitteln, die Stickstoff enthalten.
In Kohlenstoffdisulfid unlöslich (CS2) und Kohlenstofftetrachlorid (CCL4).
pH
0,41 (in Lösung 1 N, dh 1 äquivalent/l).
Dissoziationskonstante
0,101 bis 25 ° C.
Chemische Eigenschaften
Es ist eine starke Säure. Fast so viel Salzsäuren (HCL), Ni -Strickerei3) und Schwefel (h2SW4).
Kann Ihnen dienen: Sauerstoffhaltige Verbindungen: Eigenschaften, Reaktionen, VerwendungenWässrige Sulfaminsäure -Lösungen sind stark ionisiert. Sein pH -Wert ist niedriger als die Lösungen von Formik-, Phosphor- und Oxalsäuren.
In Wasser verliert Sulfaminsäure nur das Proton, der an Sauerstoff gebunden ist. Stickstoff -gejnsame Hydrogene bleiben fest vereint.
In wässriger Lösung wird es langsam hydrolysiert, um Ammoniumsäuresulfat (NH) zu ergeben4HSO4). Ist unter trockenen Bedingungen stabil.
Sulfáminsäure greift Metalle, Metalloxide und Carbonate an, um Sulfamate zu erzeugen. Zum Beispiel mit Kaliummetall (K) Kaliumsulfamat (Koso2NH2) und Wasserstoff (h2).
Alle Sulfaminsäuresalze sind in Wasser löslich. Kalzium-, Blei- und Bariumsalze sind im Gegensatz zur entsprechenden Schwefelsäure sehr löslich in Wasser.
Lessrosensäure (HNO2) reagieren quantitativ mit der Aminogruppe von Sulfaminsäure, die Stickstoff freigibt (N2). Es wird geschätzt, dass das Sulfamation in dieser Reaktion als Amida und nicht als Amin funktioniert.
Sulfáminsäure wird durch Chlor, Brom oder Kaliumchlorat oxidiert, um es in Schwefelsäure umzuwandeln. Diese Reaktion tritt bei anderen Oxidationsmitteln wie Chromsäure oder Kaliumpermanganat nicht auf.
Es ist nicht kompatibel (reagiert) mit starken Alkalis, Chlor, hypoklorischen Säure, Hypochloriten, Cyaniden und Sulfiden.
Andere Eigenschaften
Es ist nicht hygroskopisch (dies bedeutet, dass es keine Feuchtigkeit der Luft absorbiert).
Wenn er erhitzt wird, bis die Zersetzung stark giftige Dämpfe von Schwefeloxiden und Wasserstoffchlorid (HCl) emittiert.
Einer seiner Derivate, Ammoniumsulfamat, ist ein Feuerwehrleiter.
Es ist mäßig giftig.
Synthese
Sulfáminsäure wird durch die Harnstoff -Co -Reaktion (NH2)2 Mit Rauchschwefelsäure, dh Schwefelsäure (H)2SW4) Konzentrat enthält Schwefeltrioxid (also3).
Es kann auch durch Reaktion von Chlorosulfonsäure (HCLO) synthetisiert werden3Cl) und Ammoniak (NH3).
Anwendungen
In der Malvorlagenindustrie
Sulfáminsäure wird verwendet, um überschüssige Nitriten schnell und effektiv bei Diazotisierungsreaktionen bei der Farbsynthese zu entfernen. Für diesen Zweck ist es viel praktischer als Harnstoff.
In Lederverarbeitung
Während der Lederverletzung liefert die Verwendung von Sulfaminsäure anstelle von Schwefelsäure eine dünnere und seidigere Textur.
Kann Ihnen dienen: MetallmineralienDa Calciumsulfamat wasserlöslich ist, kann Sulfáminsäure im Gegensatz zu Calciumsulfat im enttäuschten Prozess verwendet werden, ohne Flecken zu lassen, die manchmal in Leder auftreten, wenn sie Schwefelsäure verwendet.
 Lederschuhe. Quelle: Pixabay.
Lederschuhe. Quelle: Pixabay. In Reinigungsprozess Geräten
Sulfámicsäure wird als Abkleberreiniger in Strahlen, Reaktoren, Rohren, Kühlsystemen und Wärmetauschern verwendet.
In diesen Geräten werden Inlays für die Zirkulation von Wasser oder Verbindungen des Prozesses in Energieanlagen, Chemiepflanzen, Ansätzen, Papierfabriken, Kompressionsstationen und anderen Branchen gebildet.
Inlays oder feste Ablagerungen können organisch (Algen, Schlick, Pilze) oder anorganische (Eisenoxide, Eisensulfide, Calcium oder Magnesiumcarbonate, Sulfate, Phosphate oder Silikate) sein.
Sulfáminsäure ist sehr effektiv, wenn es verwendet wird, um Calciumcarbonatinlays zu beseitigen. Es kann in Kupfergeräten, Messing, Edelstahl, Gusseisen und verzinktem Stahl verwendet werden.
Es wird in einer 5-10% igen Lösung zum Gewicht verwendet. Es wird vor allem in Zuckermühlen verwendet, um Verdampfer aus Gusseisen mit Kupferwärmetauschern zu reinigen.
 Verdampferteam in einer Zuckermühle. Autor: Antiksh Kumar. Quelle: Pixabay
Verdampferteam in einer Zuckermühle. Autor: Antiksh Kumar. Quelle: Pixabay Es sollte bei Temperaturen nicht mehr als 50-60 ºC verwendet werden. 70 ° C -Temperaturen führen zur Bildung von unlöslichen Sulfaten wie dem Fall4.
Bei Verwendung mit Natriumchlorid tritt ein Synergieffekt auf, und die Lösung ermöglicht es, dass das Eisenoxid langsam auflöst. In diesem Fall sollte es nicht mit Edelstahl verwendet werden, da Salzsäure freigesetzt wird, was in diesem Material Korrosion verursachen kann.
In der Metallraffinierung
Metallelektrodeposition wie Kupfer, Silber, Kobalt, Nickel, Zink, Cadmium, Eisen und Blei können erfolgreich in Sulfaminsäurelösungen durchgeführt werden. Dies kann viel einfacher als hydrophable Säuresäure (H) behandelt werden2Sif6).
Als Musterreagenz im Labor
Angesichts bestimmter Merkmale von Sulfaminsäure wie: seine Kraft als Säure, seine Leichtigkeit, die durch Rekristallisation in Wasser, seine Stabilität und ihre Nicht-Hydroskopizität gereinigt werden soll, wurde als Hauptstandard auf Laborebene verwendet. Dies bedeutet, dass es für quantitative Alkalis -Bestimmungen verwendet wird.
 Labor. PublicDomainPictures. Quelle: Pixabay
Labor. PublicDomainPictures. Quelle: Pixabay In der Nitritesanalyse
Aufgrund seiner einfachen Reaktion mit Nitriten wird Sulfáminsäure zur Bestimmung dieser in Lösung verwendet.
Kann Ihnen dienen: Tricloroessigsäure: Struktur, Eigenschaften, Synthese, Verwendungen, EffekteIn der Wasseranalyse in Wasser gelöst
Da die reagierende Sulfaminsäure mit Wassernitriten Stickstoff freigesetzt wird, ist es möglich, in Wasser gelöste Sauerstoff zu bestimmen, da die durch Nitriten verursachten Störungen beseitigt werden.
In der Herstellung von Lachoxid
Sulfáminsäure reagiert mit Salpetersäure, die Lachoxid erzeugen (N)2ENTWEDER). Diese Reaktion ist sicherer als Ammoniumnitrat, um das Gas zu erhalten.
In der Landwirtschaft
Ein Sulfámsäurerivat, Ammoniumsulfamat, ist ein nicht -toxisches Herbizid für Tiere.
Es wird von TEW auf den Blättern der Arten angewendet, die am Ende des Sommers oder an den Anfängen des Herbstes beseitigt werden sollen, vorzugsweise bei feuchtem Wetter. Nach dem Bewegen der Verbindung von den Blättern zu den Wurzeln stirbt die Pflanze.
 Rocío Herbizidanwendung. Autor: Zefe Wu. Quelle: Pixabay
Rocío Herbizidanwendung. Autor: Zefe Wu. Quelle: Pixabay Ein weiterer Vorteil dieser Verbindung besteht darin, dass der Boden nicht dauerhaft sterilisieren. In der Tat wird ein Ammoniumsulfamat -Stickstoff vor Ort für das Pflanzenwachstum in der nächsten Saison verfügbar sein.
In feuerfesten Stoffen
Seine Kompatibilität mit Cellulose und seinem feuer resentärer charakteristischen Umwandlung von Ammoniumsulfamat in ein Mittel, um feuerresistente Stoffe und Papier zu erhalten.
10% des Gewichts des Stoffes wird verwendet, dessen Aussehen und Berührungsempfinden unverändert bleiben. Der Stoff, der in Gebrauch ist.
Es ist nützlich, insbesondere in Theatern oder ähnlichen Orten.
 Theater. Autor: Mustangjoe Quelle: Pixabay
Theater. Autor: Mustangjoe Quelle: Pixabay In verschiedenen Anwendungen
Es wird in einigen chemischen Reaktionen als Katalysator verwendet, wie bei der Herstellung von Harnstoffformalharzen. Es ist auch nützlich als Bakterizid und Stabilisator von Chlor in Schwimmbädern und als hölzerne Zellstoffbleiche in Zellstoff- und Papierfabriken.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Sulfaminsäure. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung
- Williams, d.L.H. (2004) Nitrosation in Stickstoffzentren. In Nitrosationsreaktionen und der Chemie des Stickoxids. Kapitel 2. Von Scientedirect erholt.com
- Clapp, Leallyn B. (1943). Sulfaminsäure und ihre Verwendung. Chem. Bildung. 1943, 20, 4, 189. Aus Pubs geborgen.ACS.Org
- McDonald, James. (2003). Sulfaminsäure. Von Veoliaswatertech geborgen.com
- Sastri, v.S. (2010). Verwaltung und Kontrolle der Korrosion. In Shreirs Korrosion. Von Scientedirect erholt.com
- Bajpai Pratima. (2018). Verschiedene Themen. In Biermanns Handbuch von Zellstoff und Papier. Dritte Edition. Von Scientedirect erholt.com
- « Akute Klänge Eigenschaften und Beispiele
- Struktur der Monozatenary Virus, Replikation, Wichtigkeit »

