Sulfonsäurestruktur, Nomenklatur, Eigenschaften, verwendet
- 2007
- 384
- Rieke Scheer
Es wird genannt Sulfonsäure Bei allen Verbindung zu einer Familie von organischen Säuren, die eine oder mehrere Gruppen haben -so3H. Bestimmte Autoren geben an, dass die Vaterverbindung H-S (= O) ist2-Oh oder h-so3H, von einer „Sulfonsäure“ genannt, ist jedoch weder nachgewiesen, noch die seines HO -S -Tautomers (= O) -OH als "Schwefelsäure" (h) (H2SW3), weder in Lösung noch im Festkörperzustand.
Letzteres liegt daran, dass Schwefeldioxidgas (iv) (so2) In wässriger Lösung wird es zu Bisulfitionen (HSO3-) und Pyrosulfit (s)2ENTWEDER52-) Und nicht zu h-s (= o)2-OH oder Ho -S (= O) -OH, das von vielen chemischen Forschern bereits nachgewiesen wurde.
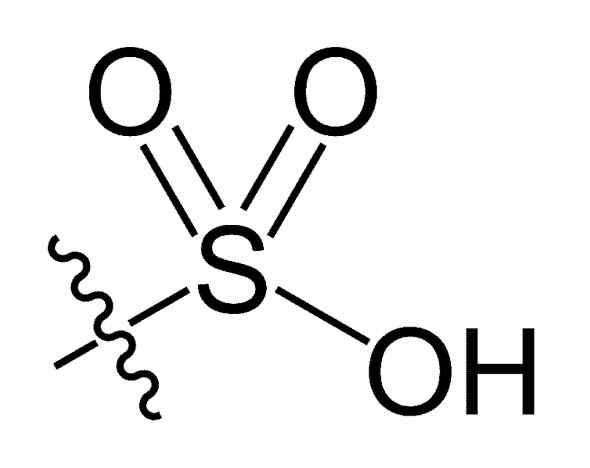
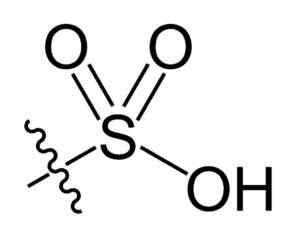 Sulfonil -Gruppe. Choij [Public Domain]. Quelle: Wikipedia Commons
Sulfonil -Gruppe. Choij [Public Domain]. Quelle: Wikipedia Commons In der r-so chemischen Formel3H von Sulfonsäuren, Gruppe R kann Kohlenwasserstoffskelette wie Alkan, Alqueno, Alchene und/oder Sand darstellen. Diese können sekundäre Funktionen wie Ester, Ether, Keton, Amino, Amido, Hydroxyl, Carboxyl- und Phenolgruppen enthalten.
Sulfonsäuren sind starke Säuren, vergleichbar mit Schwefelsäure (H)2SW4). Der Rest seiner Eigenschaften hängt jedoch weitgehend von der Art der Gruppe r ab.
Einige neigen dazu, bei hohen Temperaturen zu Desulfonar zu Desulfonar. Dies bedeutet, die Gruppe zu verlieren -so3H, besonders wenn R ein sandig ist, das heißt mit Benzolring.
Sulfonsäuren haben in Abhängigkeit von ihrer chemischen Formel viele Verwendungen. Sie werden zur Herstellung von Farbstoffen, Tinten, Polymeren, Reinigungsmitteln, Tensiden und als Katalysatoren verwendet.
[TOC]
Struktur
Sulfonsäuren haben die folgende allgemeine Struktur:
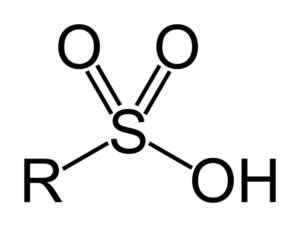 Allgemeine Formel von Sulfonsäuren. Benjah-BMM27 [Public Domain]. Quelle: Wikipedia Commons
Allgemeine Formel von Sulfonsäuren. Benjah-BMM27 [Public Domain]. Quelle: Wikipedia Commons Nomenklatur
- Sulfonil -Gruppe: -so3H
- Gemietet oder Arilsulfonsäure: r-so3H
Eigenschaften
Sie sind abhängig von der Gruppe r fest oder flüssig. Es sind keine gasförmigen Sulfonsäuren bekannt.
Seine physikalischen und chemischen Eigenschaften hängen von der Art der Gruppe r ab r. Im Vergleich gibt es einige physikalische Eigenschaften mehrerer Sulfonsäuren, wobei p.F. Es ist der Schmelzpunkt und p.Und. Es ist der Siedepunkt bei einem Druck von 1 mm Hg:
- Metanosulfonsäure: P.F. 20 ºC; P.Und. 122 ºC
- Etanosofonsäure: P.F. -17 ºC; P.Und. 123 ºC
- Proposulfonsäure: P.F. -37 ºC; P.Und. 159 ºC
- Butanosulfonsäure: P.F. -15 ºC; P.Und. 149 ºC
Kann Ihnen dienen: Eisenchlorid (FECL2): Struktur, Verwendungen, Eigenschaften- Pentosulfonsäure: P.F. -16 ºC; P.Und. 163 ºC
- Hexanosulfonsäure: P.F. 16 ºC; P.Und. 174 ºC
- Benzefonsäure: P.F. 44 ºC; P.Und. 172 ºC (bei 0,1 mm Hg)
- P-toluensulfonsäure: p.F. 106 ºC; P.Und. 182 ºC (bei 0,1 mm Hg)
- 1-Naphthalsulninsäure: P.F. 78 ºC; P.Und. Es zersetzt sich
- 2-Naphthalensulfonsäure: P.F. 91 ºC; P.Und. Es zersetzt sich
- Trifluormethanosulfonsäure: P.F. keiner; P.Und. 162 ºC (bei 760 mm Hg)
Die meisten sind sehr löslich im Wasser.
Sulfonsäuren sind noch mehr Säuren als Carbonsäuren. Sie haben ähnlich wie die von Schwefelsäure. Sie lösten sich in wässriger Natriumhydroxid und wässrigem Bicarbonat.
Sie leiden dazu, thermische Zersetzung zu leiden und ihre Entwüste aufzutreten. Einige der Alkosulfonsäuren sind jedoch thermisch stabil. Insbesondere Trify Säure oder Trifluormethanesulfonsäure sind eine der stärksten und stabilsten Säuren.
Erhalten
Arilsulfonsäuren
Ailsulfonsäuren werden im Allgemeinen durch den Sulfonierungsprozess erhalten, der aus einem Überschuss an Rauchschwefelsäure (H "besteht2SW4 + SW3) Zu der organischen Verbindung wollen wir Sulfonar. Zum Beispiel im Fall von Benzol:
C6H6 + H2SW4 C6H5SW3H + h2ENTWEDER
ARH + H2SW4 Arso3H + h2ENTWEDER
Die Sulfonierung ist eine reversible Reaktion, denn wenn wir Benzulfonsäure eine verdünnte Säure erweitern und Dampf auf das Mixt geben3 Und Benzol wird durch Verflüchtigung mit Dampf destilliert, wodurch das Gleichgewicht zur Entschwefelung verdrängt wird.
Das Sulfonante Mittel kann auch Chlorosulfursäure, Sulfaminsäure oder Sulfitionen sein.
Alkylofonsäuren
Diese werden im Allgemeinen durch Sulfooxidation hergestellt, dh Behandlung von Alkylverbindungen mit Schwefeldioxid SO2 und Sauerstoff oder2, oder direkt mit Schwefeltrioxid so3.
Rh + 2so2 + ENTWEDER2 + H2Oder r-so3H + h2SW4
Anwendungen
Sulfonsäuren für Tenside und Waschmittel
Alkybenthe Säuren werden zur Herstellung von Reinigungsmitteln verwendet, die eine der am weitesten verbreiteten Verwendungszwecke sind.
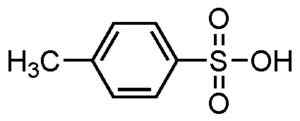 P-Methylbenzefonsäure. Su-no-g. Quelle = selbstgemacht. *Datum = 21. August 2006. *Hergestellt mit Chemdraw. Quelle: Wikipedia Commons.
P-Methylbenzefonsäure. Su-no-g. Quelle = selbstgemacht. *Datum = 21. August 2006. *Hergestellt mit Chemdraw. Quelle: Wikipedia Commons. Sie werden für pulverisierte und flüssige Waschmittel, Reinigungsmittel für schwere oder leichte Aufgaben, Hände und Shampoo -Seifen verwendet.
Die aktiven Komponenten sind im Allgemeinen die alkybenzol linearen und schwefelhaften Fettester.
Da Tenside häufige Alpha-Olefinsulfonate sind.
Kann Ihnen dienen: Natriumoxalat (Na2C2O4): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenDiese Tenside finden die Verwendung in Haushaltsreinigungsprodukten, Kosmetik, Polymerisation in Emulsionen und chemischer Herstellung für die Landwirtschaft.
Die Ligosulfonate werden von Lignin, einem Bestandteil von Holz, abgeleitet und werden als Verbreitung, Feuchtigkeitsmittel, Bindungsmittel in Straßenrandstücken, Betonzusatzstoffe und Additive in Tierfutter verwendet.
Eine abgeleitete 2-Naphtalanosulfonsäure wird verwendet, um die Zementfluidität und -festigkeit zu erhöhen.
Sulfonsäure -basierte Färbung
Diese sind im Allgemeinen durch AZO-Gruppen (r-n = n-r) gekennzeichnet.
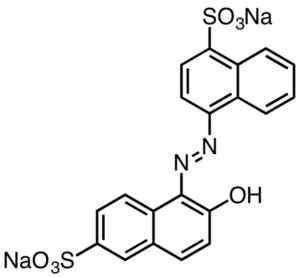 Säurerote Färbung. Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons.
Säurerote Färbung. Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikipedia Commons. Sulfonsäure -abgeleitete Farbstoffe haben Nützlichkeit in der Papierindustrie, Tinten wie Injektionsdruck, Textilien wie Baumwolle und Wolle, Kosmetik, Seifen, Waschmittel, Lebensmittel und Leder.
Ein 2-Naphtalanosulfonsäure-Derivat wird auch als Farbzutat für Polyesterfasern und Lederbräste verwendet.
Amide basiert auf Sulfonsäuren
Diese Anwendung unterstreicht die Acrylamidfonsäuren, die Polymere in Metallelektrode verwenden, wie Tenside und in transparenten Anti -Companions -Beschichtungen.
Sie werden auch bei der Verbesserung der Ölrückgewinnung als zusammengesetzte Wirkstoffe auf Boden, in hydraulischen Zementmischungen und als Aminoplastikharzen verwendet.
Einige Sulfonamide werden auch in Insektizidformeln verwendet.
Fluor- und Chlorfluor -Sulfonsäuren
Diese Gruppe unterstreicht die Trifluormethanosulfonsäure (vgl3SW3H), auch Trify Säure genannt. Diese Verbindung hat eine organische Synthese- und Polymerisationsreaktionen Katalyse.
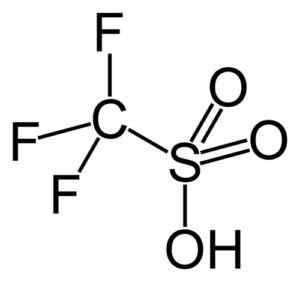 Trifizsäure. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons.
Trifizsäure. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons. Zum Beispiel wird es bei der Polymerisation aromatischer Olefine und zur Herstellung von hoch verzweigten paraffinischen Kohlenwasserstoffen mit einer hohen Oktanzahl verwendet, um sie als Kraftstoffzusatzstoffe zu verwenden.
Ein weiterer seiner Anwendungen liegt in der Synthese von leitenden Polymeren mittels Polyacethylen -Dotierung, beispielsweise Halbleiter vom Typ Typ P.
Pentafluoretanosulfonsäure (vgl3Vgl2SW3H), bekannt als Pentaplinsäure, wird als organischer Katalysator verwendet.
Trify Säure reagiert mit Antimon Pentafluorid (SBF5) Erzeugen Sie die sogenannte "Magic Säure", ein Super -Amerhy -Katalysator, der für die Alkylierung und Polymerisation dient.
Kann Ihnen dienen: Jodtinktur: Eigenschaften, Verwendungszwecke, KontraindikationenNafion-H ist ein Ionenaustauschharz einer parfümierten Polymersulfonsäure. Es hat das Merkmal, inert zu starken Säuren, starken Basen und Reduzieren oder Oxidationsmitteln.
In biologischen Anwendungen
Eine der wenigen Sulfonsäuren, die in der Natur gefunden wurden.
Synthetische und natürliche Stierkämpfe werden als Nahrungsergänzungsmittel in Tiernahrung und pharmazeutischen Produkten verwendet.
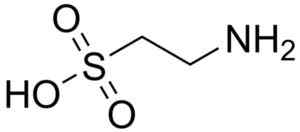 Stierkampfmolekül. Harbinary. Quelle: Wikipedia Commons
Stierkampfmolekül. Harbinary. Quelle: Wikipedia Commons Taurokolsäure ist eine Gallenkomponente und beteiligt sich an der Verdauung von Fetten. 8-anilino-1-naphtalanosulfonsäure, eine synthetische Verbindung, wird in der Untersuchung von Proteinen verwendet.
Harnstoffcopolymere und Biphenyldisulfonsäure wurden als Herpes -Simplex -Virus -Inhibitoren verwendet.
Einige Sulfonsäurerivate wie sulfoniertes Polystyrol und einige Azokompiestos haben Hemmeigenschaften von menschlichem Immundefizienz oder HIV -Virus gezeigt, ohne gegen Wirtszellen übermäßig toxisch zu sein.
In der Ölindustrie
Bestimmte Gemische von Ölderivaten, zu denen eine unterschiedliche Kombination von aromatisch.
Diese Ölsulfonate haben die Eigenschaft, die Operationspannung im Wasser zu senken. Darüber hinaus ist die Produktion sehr niedrig.
Aus diesem Grund werden Ölsulfonate in bestehende Ölbohrungen injiziert.
In der Formulierung von Schmiermitteln und Antikorrosiven
Magnesiumsulfonate haben bei Schmiermittelformeln wie detergagierende Zusatzstoffe und Verschleißvermeidung weit verbreitet.
Bariumsulfonate werden in Anti -Flint -Schmiermitteln für Verwendungszwecke verwendet, die in Hochgeschwindigkeitsanwendungen verwendet werden. Natrium- und Calciumsulfonate haben Schmiermittel und Fettfette, um extreme Druckeigenschaften zu verbessern.
Sulfonsäure -Magnesiumsalze sind auch nützlich für antikorrosive Anwendungen wie Beschichtungen, Fette und Harze.
Verweise
- Falk, Michael und Giguere, Paul a. (1958). Auf die Natur der schwefeligen Säure. Canadian Journal of Chemistry, vol. 36, 1958. Von nrcresearchPress wiederhergestellt.com
- Betts, r.H. und Voss, r.H. (1970). Die Kinetik des Sauerstoffaustauschs zwischen Sulfition und Wasser. Canadian Journal of Chemistry, vol. 48, 1970. Von nrcresearchPress wiederhergestellt.com
- Baumwolle, f.ZU. Und Wilkinson, G. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. Kapitel 16. John Wiley & Söhne.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 23. Vierte Edition. John Wiley & Söhne.
- Kosswig, Kurt. (2012). Tenside. Ullmanns Enzyklopädie der Industriechemie Vol. 35. Wiley-vch Verlag GmbH & Co.
- « Chlordioxid (CLO2) -Struktur, Verwendungen, Erhalten, Risiken, Eigenschaften
- Polyaktinsäurestruktur, Eigenschaften, Synthese, verwendet »

