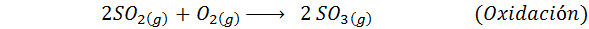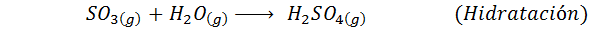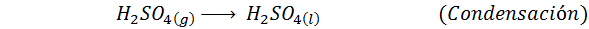Schwefelsäure (H2SO4)

- 4941
- 626
- Luca Holdt
Wir erklären, welche Schwefelsäure, seine chemische Struktur, Eigenschaften, wie sie erhalten wird, Anwendungen und Gebrauchsrisiken sind
 Schwefelsäureboote (H2SO4)
Schwefelsäureboote (H2SO4) Was ist Schwefelsäure?
Er Schwefelsäure, Auch als Wasserstoffsulfat und Vitriolöl bezeichnet, handelt es sich um eine Oxazidschwefelsäure, die durch die Schwefelanhydrid -Reaktion gebildet wird (SO3) und Wasser. Seine molekulare Formel ist h2SW4 Und es ist bei weitem die am meisten produzierte und gebrauchte Mineralsäure.
Es ist eine starke und hochkarrosiv.
Die hohen Produktions- und Verbrauchsvolumina dieser Verbindung sind auf ihre zahlreichen Anwendungen in Branchen zurückzuführen.
Schwefelsäurestruktur
Schwefelsäure wird durch ein zentrales Schwefelatom mit Valencia VI gebildet, das von 4 Sauerstoffatomen umgeben ist, von denen zwei mit Wasserstoffatomen verbunden sind. Seine Lewis -Struktur wird unten dargestellt:
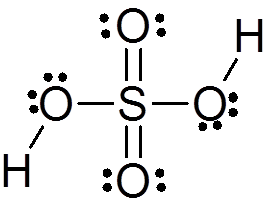
Wie Sie sehen können, ist Schwefel in dieser Verbindung von 12 Elektronen (6 Paar) umgeben, sodass er eine der Ausnahmen der Oktettregel darstellt.
Die Theorie der Abstoßung der Elektronenpaare von Valencia (Trepev) sagt voraus, dass diese Verbindung eine ungefähr tetraedrische Geometrie annehmen muss, die im folgenden Bild gezeigt wird:
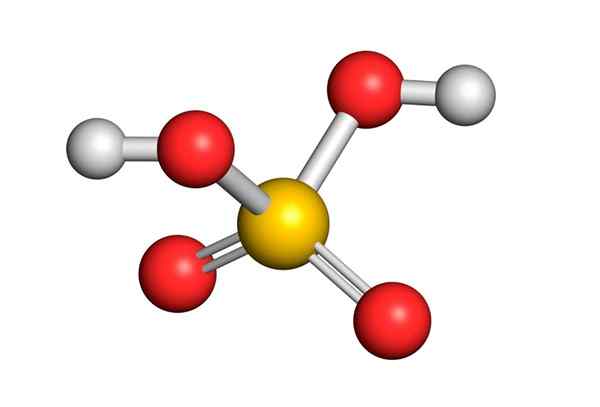
Aufgrund der hohen Elektronegativität von Sauerstoff und den verschiedenen Resonanzstrukturen, die Schwefelsäure haben können, sind die Bindungen zwischen Sauerstoff und Hydrogenen stark polarisiert, was sie sehr sauer und leicht zu dissoziieren kann, was es zu dissoziieren kann.
Schwefelsäureeigenschaften
Infolge seiner Struktur hat Schwefelsäure die folgenden physikalischen und chemischen Eigenschaften:
Es kann Ihnen dienen: Epoxid: Nomenklatur, erhalten, Anwendungen, BeispielePhysikalische Eigenschaften
- Reine Schwefelsäure ist eine farblose und Toilettenflüssigkeit mit einer Dichte von 1.8302 g/ml.
- Der Schmelzpunkt beträgt 10,31 ° C und das Kochen 337 ° C, obwohl es bei dieser Temperatur dazu neigt, Wasser und Schwefelanhydrid zu produzieren (auch Schwefeltrioxid genannt).
- Es ist vollständig mit Wasser mischbar, sodass Sie Lösungen mit jeder Konzentration vorbereiten können. Lösungen mit mehr als 98,3% in der Masse dieser Säure sind jedoch instabil und die Säure zersetzt, bis seine Konzentration auf 98,3% abnimmt. Diese Lösung ist stabil und ist das, was als konzentrierte Schwefelsäure bekannt ist.
- In seinem reinen oder konzentrierten Zustand ist es eine viskose Flüssigkeit als Wasser.
Chemische Eigenschaften
- Reine Schwefelsäure ist eine stark oxidationsmittelmäßige und ätzende Substanz. Es hat die Fähigkeit, zu einer Vielzahl von organischen Verbindungen zu oxidieren, dehydrieren und sulfonar.
- Es handelt4-). Dieses Ion ist auch eine Säure, obwohl schwächer als die ursprüngliche Säure.
- Wässrige Schwefelsäurelösungen sind stark sauer und können viele Metalle auflösen, wodurch gasförmiger Wasserstoff erzeugt wird. Sie sind auch in der Lage, starke Basen vollständig zu neutralisieren.
- Reagiert heftig mit vielen Alkoholen und Wasser und setzt dabei große Mengen an Wärme frei.
Wie wird Schwefelsäure erhalten??
Die drei bekanntesten Schwefelsäureproduktionsprozesse sind: Der Kontaktprozess, der Prozess der Nassschwefelsäure und der Prozess von Bleikameras.
1. Schwefelsäuresynthese durch den Kontaktprozess
Dies ist heute die am häufigsten verwendete Methode, um Schwefelsäure zu produzieren. Das Verfahren besteht aus 5 Schritten, in denen elementarer Schwefel Schwefeldioxid wird (also2), dann Schwefeltrioxid (also3), Disulfursäure (h2S2ENTWEDER7) und schließlich in Schwefelsäure. Die damit verbundenen Reaktionen sind:
Kann Ihnen dienen: wofür ist der Sicherheits -Rhombus und wofür ist es??
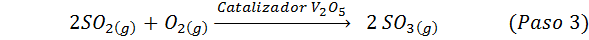


Der zweite Schritt des Prozesses besteht einfach aus der Reinigung von Schwefeldioxid, bevor er in Schwefel- oder Schwefelanhydrid -Trioxid umgewandelt wird. Die Reaktion des dritten Schritts tritt auf2ENTWEDER5), Und deshalb wird die Methode als Kontaktprozess bezeichnet.
2. Schwefelsäuresynthese durch den Nassprozess
Dieses Verfahren wurde entwickelt, um die Emissionsgase einer Vielzahl von chemischen Industrien und Pflanzen zu reinigen. Das Nebenprodukt dieser Reinigung ist zusätzlich zu heißem Wasserdampf, der im ursprünglichen Industrieprozess wiederverwendet werden kann.
Im Falle des Nassprozesses sind die Reaktionen meistens. Die wichtigen Reaktionen, die in jeder Phase auftreten, sind:
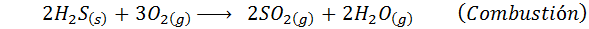
3. Schwefelsäuresynthese durch den Prozess von Bleikameras
Dies ist eine alte Methode zur Herstellung von Schwefelsäure, die heute sehr wenig verwendet wird. Das Verfahren bestand darin, den elementaren Schwefel in Gegenwart von Luftsauerstoff in Bleikammern zu verbrennen, und damit der Name.
Nach dieser Verbrennung reagiert Schwefeldioxid dann mit Stickoxiden, die durch die Zersetzung von Natriumnitrat oder auf andere Weise produziert werden. Am Ende wurde nach einer Reihe zusätzlicher Reaktionen Schwefelsäure erhalten.
Kann Ihnen dienen: Flacher HintergrundflascheGemeinsame Anwendungen
- Die Hauptanwendung von Schwefelsäure ist eine Schwefelquelle in Form von Sulfaten bei der Herstellung von Düngemitteln. Tatsächlich sind zu diesem Zweck etwa 60% der in der Welt produzierten Schwefelsäure in der Welt bestimmt.
- In der chemischen Industrie wird es zur Synthese von Reinigungsmitteln, Pigmenten, Katalysatoren für die petrochemische Industrie und in der Verarbeitung von Mineralien zur Erzielung verschiedener Metalle verwendet.
- Schließlich ist Schwefelsäure der Elektrolyt, der in den in den meisten Autos verwendeten Bleibatterien verwendet wird.
Mit Schwefelsäure verbundene Risiken
Aufgrund seiner chemischen Eigenschaften kann Schwefelsäure sowohl für Menschen als auch für Tiere und die Umwelt im Allgemeinen sehr gefährlich sein. Dies sind einige der mit dieser Chemikalie verbundenen Risiken:
- Seine ätzenden und dehydrierenden Eigenschaften machen reine Säure große Schäden, wenn es mit der Haut in Kontakt kommt.
- Andererseits erzeugt die Reaktion wässriger Schwefelsäurelösungen mit Metallen gasförmiger Wasserstoff, der ein Brennstoff und eine explosive Substanz ist.
- Schwefelsäure selbst leidet nicht an einer Verbrennungsreaktion, aber als starkes Oxidationsmittel stimuliert die Verbrennung anderer Substanzen und fungiert als eine Art Katalysator, so.
- Wenn es dem Feuer ausgesetzt ist, kann es außerdem in giftige Gase unterteilt werden und Schwefelsäuredämpfe erzeugen, die die Atemwege leicht zerstören können.
Aus diesen und mehr Gründen ist Schwefelsäure eine Substanz, die sorgfältig behandelt werden sollte.