Schwefelsäure
- 5064
- 553
- René Riediger
 Schwefelsäure ist eine Mineralsäure, die auftritt, wenn sich Schwefeldioxid in Wasser auflöst
Schwefelsäure ist eine Mineralsäure, die auftritt, wenn sich Schwefeldioxid in Wasser auflöst Was ist schwefelsäure?
Er Schwefelsäure Es ist ein Oxácido, das sich beim Schwefeldioxid bildet, also2, löst sich in Wasser auf. Es ist eine schwache und instabile anorganische Säure, die in Lösung nicht nachgewiesen werden konnte2 und h₂o).
Es ist eine farblose Flüssigkeit mit einem starken Schwefelgeruch, instabil und wird in verschiedenen Industriefeldern wie Chlorfärbematerial für die Synthese von medizinischen und chemischen Produkten für die Herstellung von Papier oder zur Verfeinerung der Ableitungen des Erdöls verwendet.
Das Schwefelsäuremolekül im Moment wurde nur in der Gasphase nachgewiesen. Die konjugierten Basen dieser Säure sind häufige Anionen unter den Formen von Sulfiten und Bisulfit.
Ramans Spektrum von SO -Lösungen2 Es zeigt nur Zeichen aufgrund des SO Moleküls2 und Bisulfite Ion, HSO3-, In Übereinstimmung mit dem folgenden Gleichgewicht:
SW2 + H₂o hso3- + H+
Dies zeigt an, dass es nach Ramans Spektrum nicht möglich ist.
Wenn sie der Atmosphäre ausgesetzt ist, wird sie schnell in Schwefelsäure umgewandelt. Schwefelsäure wird aufgrund der Wirkung von verdünnte Schwefelsäure und Zink auf Wasserstoffsulfid reduziert.
Der Versuch, eine SO -Lösung zu konzentrieren2 Durch Verdunstung von Wasser, um Wasserfreischwefelsäure zu erhalten, führte sie nicht zu einem Ergebnis, da sich die Säure schnell zersetzt.
Die Struktur von Schwefelsäure
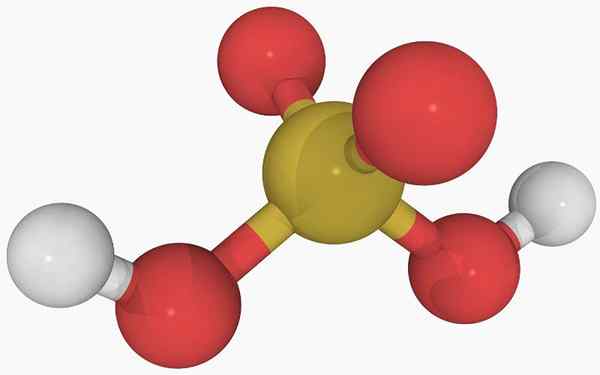
 Chemische Struktur von schwefeler Säure
Chemische Struktur von schwefeler Säure Im Hauptbild ist die Struktur eines isolierten Moleküls von schwefelförmiger Säure in einem gasförmigen Zustand zu sehen. Die gelbe Kugel in der Mitte entspricht dem Schwefelatom, den Roten zu Sauerstoffatomen und weiß zu Wasserstöbern.
Kann Ihnen dienen: DiagrammeSeine molekulare Geometrie um das S -Atom ist eine trigonale Pyramide mit den Atomen oder Zeichnen der Basis.
Dann im gasförmigen Zustand die H -Moleküle2SW3 Sie können als mikroskopische trigonale Pyramiden angesehen werden, die in der Luft schweben, vorausgesetzt, sie sind stabil genug, um einige Zeit ohne Reaktion zu halten.
Die Struktur macht deutlich, woher die beiden sauren Hydrogene stammen: aus den Hydroxylgruppen, die mit Schwefel, ho-oh-oh verbunden sind. Daher ist es für diese Verbindung nicht richtig anzunehmen, dass einer der Säureprotonen, h+, wird aus dem Schwefelatom freigesetzt, H-SO2(OH).
Die beiden OH -Gruppen lassen Schwefelsäure mit Wasserstoffbrücken interagieren, und auch der Sauerstoff der Bindung S = O ist ein Wasserstoffakzeptor, der H macht2SW3 sowohl in einem guten Spender als auch in einem Akzeptor dieser Brücken.
Nach dem oben genannten, h2SW3 Ich sollte in einer Flüssigkeit kondensieren können, wie Schwefelsäure, h2SW4. Trotzdem passiert es nicht so.
Physikalische und chemische Eigenschaften der Schwefelsäure
Molekularformel
H2SW3
Molekulargewicht
82.073 g/mol.
Aussehen
Es ist eine farblose Flüssigkeit mit einem würzigen Schwefelgeruch.
Dichte
1.03 g/ml.
Dampfdichte
2.3 (in Bezug auf die Luft als 1)
Korrosivität
Es ist korrosiv für Metalle und Gewebe.
Wasserlöslichkeit
Mischbar.
Empfindlichkeit
Es ist luftempfindlich.
Stabilität
Stabil, aber unvereinbar mit starken Stützpunkten.
Säurekonstante (KA)
1.54 x 10-2
PKA
1.81
pH
1.5 auf der pH -Skala.
Zündungspunkt
Nicht brennbar.
Zersetzung
Beim Erhitzen kann Schwefelsäure abgebaut werden, wodurch ein giftiger Rauch von Schwefeloxid emittiert werden.
Kann Ihnen dienen: Chromhydroxid: Struktur, Eigenschaften, Synthese, verwendetNomenklatur
Schwefel hat die folgenden Valences: ± 2, +4 und +6. Aus der Formel h2SW3, Es kann berechnet werden, welche Valenz oder Oxidationszahl Schwefel in der Verbindung aufweist. Dazu reicht es aus, eine algebraische Summe zu lösen:
2 (+1) + 1v + 3 (-2) = 0
Da es sich um eine neutrale Verbindung handelt, muss die Summe der Lasten der Atome, die es ausmachen, 0 sein. Löschen V für die vorherige Gleichung haben Sie:
V = (6-2)/1
Somit ist V gleich +4. Das heißt, Schwefel nimmt an seiner zweiten Valencia teil, und gemäß der traditionellen Nomenklatur muss das Suffix dem Namen -ooso hinzugefügt werden. Aus diesem Grund zu h2SW3 Es ist als Schwefelsäure bekannttragen.
Eine weitere schnellere Möglichkeit, diese Valencia zu bestimmen2SW3 mit h2SW4.
In h2SW4 Schwefel hat Valencia +6. Wenn also einer oder Valencia auf +4 sinkt und ein anderer entfernt wird, sinkt Valencia auf +2 (was bei Säure der Fall wäre SchluckaufSchwefeltragen, H2SW2).
Obwohl weniger bekannt, zu h2SW3 Es kann auch als Trioxosulfursäure (IV) bezeichnet werden, gemäß Aktiennomenklatur.
Schwefelsäurebildung in der Natur
Schwefelsäure wird in der Natur aufgrund der Kombination von Schwefeldioxid, Produkt der Aktivität großer Fabriken, mit atmosphärischem Wasser gebildet.
Aus diesem Grund gilt es als Zwischenprodukt saurer Regen.
Synthese
Technisch gesehen wird Schwefel gebildet, um Schwefeldioxid zu bilden. Dann löst es sich in Wasser auf, um Schwefelsäure zu bilden. Die Reaktion ist jedoch reversibel und die Säure bricht in den Reaktanten schnell zurück.
Dies ist eine Erklärung dafür, warum Schwefelsäure nicht in wässriger Lösung gefunden wird (wie bereits im Abschnitt ihrer chemischen Struktur erwähnt).
Kann Ihnen dienen: Bier-Lambe-GesetzAnwendungen
Im Allgemeinen sind die Verwendungen und Anwendungen der schwefelförmigen Säure, da seine Anwesenheit nicht nachgewiesen werden kann, auf die Verwendungen und Anwendungen von Schwefeldioxiden sowie die Basis und die Salze von Säure.
In Holz
Im Sulfitprozess tritt Holzzellstoff in Form fast reiner Cellulosefasern auf. Für die Extraktion von Lignin aus Holzsplintern werden mehrere Salzsäuresalze verwendet, wobei Hochdruckbehälter genannt werden.
Desinfektionsmittel
Schwefelsäure wird als Desinfektionsmittel verwendet.
Bleichen
Es wird auch als weiches Bleichmittel verwendet, insbesondere für chlorempfindliche Materialien. Darüber hinaus wird es als Zahnbleiche und Lebensmittelzusatz verwendet.
Kosmetika
Es ist ein Bestandteil verschiedener Kosmetika für die Hautpflege und wurde als Pestizidelement bei der Eliminierung von Ratten verwendet. Eliminiert Flecken, die durch Wein oder Früchte auf verschiedenen Stoffen verursacht werden.
Antiseptikum
Es dient als antiseptisch und ist wirksam, um Hautinfektionen zu vermeiden. In einigen Augenblicken wurde es in Felsbildern verwendet, um Schiffe, Habseligkeiten von Opfern von Epidemien usw. zu desinfizieren.
Konservierungsmittel
Schwefelsäure wird als Konservierungsmittel für Obst und Gemüse verwendet und um die Fermentation von Getränken wie Wein und Bier zu vermeiden, ein antioxidatives, antibakterielles und fungizides Element ist.
Chemikalien
Schwefelsäure wird in der Synthese von Medikamenten und Chemikalien, bei der Ausarbeitung von Wein und Bier, zur Verfeinerung von Ölprodukten und als analytisches Reagenz verwendet.
Verweise
- Nomenklatur von Säuren. Von 2 geborgen.Chemie.Gatech.Edu
- Calvo Flores, f. G. Formulierung der anorganischen Chemie. UGR erholte sich.Ist

