Weinsäure
- 5018
- 631
- Ibrahim Steuk
Wir erklären, was Tartarsäure, seine physikalischen und chemischen Eigenschaften, seine Struktur und ihre Anwendungen ist
Was ist Tartarsäure?
Er Weinsäure Es ist eine organische Verbindung, deren molekulare Formel COOH (CHOH) ist2Cooh. Es hat zwei Carboxylgruppen; Das heißt, Sie können zwei Protonen veröffentlichen (h+). Mit anderen Worten, es ist eine diprotische Säure. Es kann auch als Aldarsäure (saurer Zucker) und Succinsäure -Derivat klassifiziert werden.
Sein Salz ist seit jeher bekannt. Es wird als weiße Sediment kristallisiert, die als "Weindiamanten" getauft wurde, die sich im Korken oder am Boden der Fässer und Flaschen ansammeln. Dieses Salz ist Kaliumbiitartrat (oder Kaliumsäuretartrato).
Tartarsäuresalze haben gemeinsam das Vorhandensein eines oder zwei Kationen (NA+, K+. NH4+, AC2+, usw.au.
Diese Verbindung war wiederum Gegenstand des Studiums und der Lehre von organischen Theorien im Zusammenhang mit der optischen Aktivität, genauer gesagt mit der Stereochemie.
Wo ist Tartarsäure?
Tartarsäure ist ein Bestandteil vieler Pflanzen und Lebensmittel wie Aprikose, Avocados, Äpfel, Tamarindos, Sonnenblumenkerne und Trauben.
Beim Alterung der Weine wird diese Säure - zu kalten Temperaturen - mit Kalium kombiniert, um als Tartrato zu kristallisieren. In roten Weinen ist die Konzentration dieser Tartrats geringer, während sie in weißen Weinen häufiger sind.
Tartrate sind Salze weißer Kristalle, aber wenn sie Verunreinigungen der alkoholischen Umwelt verschließen, erwerben sie rötliche oder lila Töne.
Kann Ihnen dienen: VerschiebungsreaktionTartarsäurestruktur
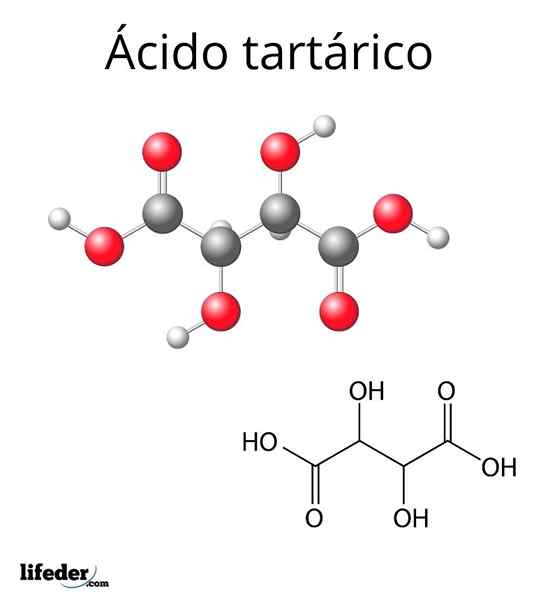
 Molekülstruktur der Tartarsäure
Molekülstruktur der Tartarsäure Die molekulare Struktur von Tartarsäure wird im oberen Bild dargestellt. Die Carboxylgruppen (-COOH) befinden sich an den Seitenenden und sind durch eine kurze Kohlenstoffkette (C) getrennt2 und C3).
Jede dieser Kohlenstoffe ist wiederum mit einem H (weißer Kugel) und einer OH -Gruppe verbunden. Diese Struktur kann die C -Verbindung drehen2-C3, So erzeugen Sie mehrere Konformationen, die das Molekül stabilisieren.
Das heißt, das zentrale Glied des zerbrochenen Moleküls als rotierender Zylinder, der nacheinander die räumliche Disposition der Gruppen -Cooh, H und OH (Newman Prognoctions) abwechselt, wechselte nacheinander ab (Newman -Projektionen).
Zum Beispiel zeigen die beiden OH -Gruppen im Bild in entgegengesetzte Richtungen, was bedeutet, dass sie in Anti -Positionen miteinander sind. Gleiches gilt für Gruppen -cooh.
Eine weitere mögliche Konformation ist die von ein paar in den Schatten stehenden Gruppen, in denen beide Gruppen in die gleiche Richtung ausgerichtet sind. Diese Konformationen würden keine wichtige Rolle in der Struktur der Verbindung spielen, wenn alle Kohlenstoffe g -Gruppen c2 und C3 Sie waren gleich.
Wie in dieser Verbindung sind die vier Gruppen unterschiedlich (-Cooh, OH, H und die andere Seite des Moleküls), Kohlenstoffe sind asymmetrisch (oder chirale) und zeigen die berühmte optische Aktivität.
Die Art und Weise, wie Gruppen in Kohlenstücken angeordnet sind2 und C3 von Tartarsäure bestimmt einige unterschiedliche Strukturen und Eigenschaften für dieselbe Verbindung; Das heißt, ermöglicht die Existenz von Stereoisomeren.
Tartarsäureanwendungen
In der Lebensmittelindustrie
Es wird als Eulsionsstabilisator in Bäckereien verwendet. Es wird auch als Zutat für Hefe, Marmelade, Gelatine und Erfrischungsgetränke verwendet. Es erfüllt auch Funktionen als Ansäuern, Bibliothek und Bieter von Ion.
Es kann Ihnen dienen: Natriumbromid (NABR)Tartarsäure befindet sich in diesen Lebensmitteln: süße Kekse, Süßigkeiten, Pralinen, Gasflüssigkeiten, Backwarenprodukte und Weine.
Bei der Ausarbeitung der Weine wird sie verwendet, um sie aus dem Sicht der Gustatory ausgeglichener zu gestalten, indem der pH -Wert von diesen verringert wird.
In der Pharmaindustrie
Es wird bei der Schaffung von Pillen, Antibiotika und sprudelnden Pillen sowie in Arzneimitteln zur Behandlung von Herzerkrankungen verwendet.
In der chemischen Industrie
Es wird sowohl in der Fotografie als auch in Galvanotechniken verwendet und ist ein ideales Antioxidans für industrielle Fette.
Es wird auch als Metall -Ionen -Entführer verwendet. Als? Drehen Sie ihre Verbindungen so, dass Sie die Sauerstoffatome der Carbonylgruppe, die reich an Elektronen sind.
In der Bauindustrie
Verzögern Sie den Prozess der Verhärtung des Gips, des Zements und des Gips, wodurch die Manipulation dieser Materialien effizienter wird.
Tartarsäureeigenschaften

Die häufigsten Anwendungen von Tartarsäure sind:
- Tartarsäure wird in Form eines kristallinen Pulvers oder leicht undurchsichtiger weißer Kristalle vermarktet. Es hat einen angenehmen Geschmack, und diese Eigenschaft zeigt einen Wein von guter Qualität.
- Schmilzt bei 206 ° C und brennt bei 210 ºC. Es ist sehr löslich in Wasser, Alkoholen, Grundlösungen und Borax.
- Seine Dichte beträgt 1,79 g/ml bei 18 ºC und zeigt zwei Säurekonstanten: PKA1 und PKA2. Das heißt, jeder der beiden Säureprotonen hat seine eigene Tendenz, sich in der wässrigen Umgebung zu befreien.
- Wie die Gruppen von -Coh und OH kann durch Infrarotspektroskopie (IR) auf ihre qualitativen und quantitativen Bestimmungen analysiert werden.
- Andere Techniken wie Massenspektroskopie und Kernmagnetresonanz ermöglichen die vorherige Analyse dieser Verbindung.
Stereochemie

Tartarsäure war die erste organische Verbindung, zu der eine enantiomere Auflösung entwickelt wurde. Was bedeutet das? Es bedeutet, dass seine Stereoisomere dank der Forschungsarbeiten des Biochemisten Louis Pasteur 1848 manuell getrennt werden könnten.
Und was sind die Stereoisomere von Tartarsäure? Dies sind: (r, r), (s, s) und (r, s). R und S sind die räumlichen Konfigurationen von Kohlenstoffen c2 und C3.
Tartarsäure (R, R), die "natürlichste", dreht das polarisierte Licht nach rechts; Tartarsäure (s, s) werden nach links gebrochen, entgegen den Taktnadeln. Und schließlich brechen Tartarsäure (R, S) das polarisierte Licht nicht und ist optisch inaktiv.
Louis Pasteur, mit Hilfe eines Mikroskops und einer Pinzette, gefundene und getrennte Tartarsäure -Kristalle, die "rechts" und "links gehandelt" Mustern zeigten, wie z. B. im überlegenen Bild.
Auf diese Weise sind die "rechts gehandelten" Kristalle diejenigen, die vom Enantiomer (R, R) gebildet werden, während die "linken" Kristalle die der Enantiomer (S, S) sind.
Die Kristalle der Tartarsäure (R, S) unterscheiden sich jedoch nicht von anderen, da sie gleichzeitig qualifizierte und links gehandelte Eigenschaften aufweisen; Daher konnten sie nicht "gelöst" werden.
Verweise
- Wikipedia. (2018). Weinsäure. Abgerufen von.Wikipedia.Org
- Pubchem. (2018). Weinsäure. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Weinkarten verstehen. Von Jordanwinery geborgen.com
- Aktiv. Weinsäure. Von Actipedia geborgen.Org
- Pochteca. Weinsäure. Pochteca erholte sich.com.mx
- Dhanesshwar Singh et al. (2012). Auf den Ursprung der optischen Inaktivität von Meso-Tartarsäure. Abteilung für Chemie, Universität Manipur, Canchipur, Imphal, Indien. J. Chem. Pharm. Rindfleisch., 4 (2): 1123-1129.

