Yodhydsäure (HI) -Struktur, Eigenschaften und Verwendung

- 1758
- 502
- Said Ganzmann
Er iarhydrische Säure Es ist eine wässrige Lösung von Wasserstoffiodid, die durch seine hohe Säure gekennzeichnet ist. Eine Definition, die mehr an die chemische Terminologie und die IUPAC gebunden ist, ist, dass es sich um eine Hydratie handelt, deren chemische Formel HI ist.
Um es jedoch von den gasförmigen Molekülen von Wasserstoffiodid, HI (G), zu unterscheiden, wird es als HI (AC) bezeichnet. Aus diesem Grund ist es in chemischen Gleichungen wichtig, die Umwelt oder physikalische Phase zu identifizieren, in der Reagenzien und Produkte waren. Trotzdem sind verwirrte zwischen Wasserstoffiodid und Iarchlorsäure normalerweise häufig.
 Iarhydrische Säureionen. Quelle: Gabriel Bolívar.
Iarhydrische Säureionen. Quelle: Gabriel Bolívar. Wenn die engagierten Moleküle in ihrer Identität beobachtet werden, werden berüchtigte Unterschiede zwischen HI (G) und HI (AC) gefunden. In der Hi (g) gibt es einen H-I-Link; Während im HI (AC) sind sie tatsächlich ein Paar Ionen i- und h3ENTWEDER+ Wechselwirkung von Electrlostátical (überlegenes Bild).
Andererseits ist das HI (AC) eine Quelle von HI (g), da der erste durch die Auflösung des zweiten in Wasser hergestellt wird. Aus diesem Grund kann HI auch nicht verwendet werden. Das HI ist ein starker Reduktionsmittel und eine hervorragende Quelle von Ionen I- In wässrigem Medium.
[TOC]
Yodhydric -Säurestruktur
Yodhydricsäure besteht, wie erklärt, aus einer HI -Lösung in Wasser. Hi -Moleküle im Wasser sind vollständig (starker Elektrolyt) und entstehen die Ionen I- und h3ENTWEDER+. Diese Dissoziation kann mit der folgenden chemischen Gleichung dargestellt werden:
Hi (g) + h2Oder (l) => i-(Ac) + h3ENTWEDER+(Ac)
Was wäre gleichwertig, wenn geschrieben wird wie:
Hi (g) + h2Oder (l) => hi (ac)
Hi (AC) zeigt jedoch überhaupt nicht, was mit den gasförmigen Hi -Molekülen passiert ist; Es zeigt nur an, dass sie sich in wässrigem Medium befinden.
Daher besteht die wahre Struktur von HI (AC) aus Ionen I- und h3ENTWEDER+ umgeben von Wassermolekülen, die sie mit Feuchtigkeit versorgen; Je konzentrierter die iarhydrische Säure ist, desto geringer ist die Anzahl der Wassermoleküle ohne Proton.
Kann Ihnen dienen: Boyle LawTatsächlich beträgt die HI -Konzentration im Handel 48 bis 57% im Wasser; Konzentrierter wäre gleichbedeutend mit einer Säure zu rauchen (und noch gefährlicher).
Im Bild ist zu sehen, dass Anion i- Es wird mit einer lila Kugel dargestellt, und h3ENTWEDER+ Mit weißen Kugeln und einem Rot für Sauerstoffatom. Das Kation h3ENTWEDER+ Präsentiert molekulare Geometrie -trigonale Pyramide (aus einer höheren Ebene im Bild).
Eigenschaften
Physische Beschreibung
Farblose Flüssigkeit; Sie können jedoch gelbliche und braune Töne aufweisen, wenn Sie direkt mit Sauerstoff in Kontakt stehen. Das liegt daran, dass Ionen i- Sie werden am Ende molekulares Jod oxidieren, ich2. Wenn es viel gibt, ich2, Es ist mehr als wahrscheinlich, dass das Triaduro -Anion gebildet wird, ich3-, die die Lösung als braun färbt.
Molekulare Masse
127,91 g/mol.
Geruch
Acre.
Dichte
Die Dichte beträgt 1,70 g/ml für die 57%HI -Lösung; Da variieren die Dichten je nach den verschiedenen Konzentrationen von HI. Diese Konzentration bildet ein Azeotrop (sie wird als einzelne Substanz destilliert und nicht als Mischung), dessen relative Stabilität seine Kommerzialisierung über anderen Lösungen geschuldet werden kann.
Siedepunkt
Die 57% HI -Azeotrope kocht bei 127 ° C bei einem Druck von 1,03 bar (Pass zu ATM).
PKA
-1.78.
Säure
Es ist eine extrem starke Säure, so sehr, dass sie für alle Metalle und Gewebe korrosiv ist. Auch für Gummi.
Dies liegt daran. Darüber hinaus ist Wasserstoffbrücken i- - HOH2+ Sie sind schwach, also gibt es nichts zu stören, was das h beeinträchtigt3ENTWEDER+ reagieren mit anderen Verbindungen; das heißt, h3ENTWEDER+ hat "frei", wie das ich- Das zieht nicht zu viel für seine Gegenion an.
Kann Ihnen dienen: PycnometerReduktionsmittel
Das HI ist ein leistungsstarker Reduktionsmittel, dessen Hauptreaktionsprodukt i ist2.
Nomenklatur
Die Nomenklatur von iarhydricsäure stammt aus der Tatsache, dass das Jod "funktioniert" mit einem einzigen Oxidationszustand: -1. Und außerdem zeigt der Name an, dass er Wasser in seiner strukturellen Formel hat [i-] [H3ENTWEDER+]. Dies ist der einzige Name, da es sich nicht um eine reine Verbindung, sondern eine Lösung handelt.
Anwendungen
Jodquelle in der organischen und anorganischen Synthese
Das HI ist eine hervorragende Quelle von Ionen I- für anorganische und organische Synthese und ist auch ein leistungsstarker Reduktionsmittel. Zum Beispiel wird seine 57% ige wässrige Auflösung für die Synthese von Alkyliodiden verwendet (wie CHO3CH2I) von primären Alkoholen. Ebenso kann eine OH -Gruppe in einer Struktur durch ein i ersetzen.
Reduktionsmittel
Yodhydricsäure wurde verwendet, um beispielsweise Kohlenhydrate zu reduzieren. Wenn die in dieser Säure gelöste Glukose erhitzt wird, verliert sie alle OH-Gruppen und erhalten als Produkt das N-Hexan-Kohlenwasserstoff.
Ebenso wurde es verwendet, um funktionelle Gruppen von Graphenblättern zu reduzieren, damit sie für elektronische Geräte funktionalisiert werden können.
Cativa -Prozess
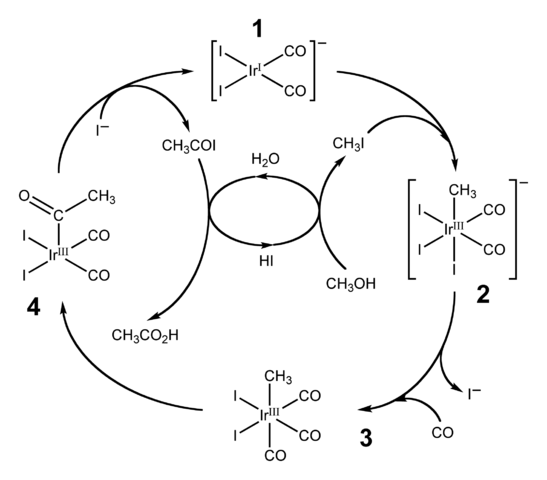 Diagramm des katalytischen Zyklus für den Cativa -Prozess. Quelle: Ben Mills [Public Domain Domain].Das HI wird auch für die industrielle Produktion von Essigsäure durch den Cativa -Prozess verwendet. Dies besteht aus einem katalytischen Zyklus, in dem Methanol -Carbonilation auftritt; das heißt, zum Molekül von CH3Oh, eine Carbonylgruppe wird eingeführt, c = o, um sich in Cho -Säure zu verwandeln3Cooh.
Diagramm des katalytischen Zyklus für den Cativa -Prozess. Quelle: Ben Mills [Public Domain Domain].Das HI wird auch für die industrielle Produktion von Essigsäure durch den Cativa -Prozess verwendet. Dies besteht aus einem katalytischen Zyklus, in dem Methanol -Carbonilation auftritt; das heißt, zum Molekül von CH3Oh, eine Carbonylgruppe wird eingeführt, c = o, um sich in Cho -Säure zu verwandeln3Cooh.
Schritte
Der Prozess beginnt (1) mit dem Organo-IRidium-Komplex [IR (CO)2Yo2]-, von quadratischer flacher Geometrie. Diese Verbindung "erhält" das Methyliodid, Ch3I, Produkt der Cho -Versauerung3Oh mit 57% Hallo. Wasser tritt auch in dieser Reaktion auf, und dank ihr wird am Ende Essigsäure erhalten, während sich das HI im letzten Schritt erholen kann.
Kann Ihnen dienen: KolloidIn diesem Schritt sowohl die Gruppe -ch3 Als das -ich das Ididio Metal Center (2) verbindet und einen oktaedrischen Komplex mit einer Facette aus drei Liganden bildet und. Einer der Yodos ersetzt sich am Ende durch ein Kohlenmonoxidmolekül, CO; Und jetzt (3) hat der oktaedrische Komplex eine Facette, die aus drei Co -Liganden besteht.
Dann tritt eine Neubelastung auf: die -ch -Gruppe3 Es wird von IR "freigegeben" und verbindet sich dem benachbarten (4), um eine Acetylgruppe zu bilden, -Koch3. Diese Gruppe wird aus dem Iridido -Komplex entlassen, um mit den Iodidionen zu verknüpfen und Cho zu geben3COI, Acetyljodid. Hier wird der Iridium -Katalysator geborgen und bereit, an einem anderen katalytischen Zyklus teilzunehmen.
Schließlich Cho3COI leidet an einem Ersatz des i- Für ein H -Molekül2Oder, dessen Mechanismus endet, indem er Hi und Essigsäure freigibt.
Illegale Synthese
 Efedrinreduktionsreaktion mit rotem phosphorisch und phosphor zu methaphetamin. Quelle: methamphetamine_from_ephedrine_with_hi_ru.SVG: Abgeleitetes Ring0 Trabajo: MaterialScientist (Sprechen) [Public Domain].Yodhydrische Säure wurde zur Synthese der psychotropen Substanz verwendet, die ihre hohe reduktive Kraft nutzt. Zum Beispiel können Sie Ephedrin (ein Medikament zur Asthmabehandlung) in Gegenwart von rotem Phosphor auf Methamphetamin (überlegenes Bild) reduzieren.
Efedrinreduktionsreaktion mit rotem phosphorisch und phosphor zu methaphetamin. Quelle: methamphetamine_from_ephedrine_with_hi_ru.SVG: Abgeleitetes Ring0 Trabajo: MaterialScientist (Sprechen) [Public Domain].Yodhydrische Säure wurde zur Synthese der psychotropen Substanz verwendet, die ihre hohe reduktive Kraft nutzt. Zum Beispiel können Sie Ephedrin (ein Medikament zur Asthmabehandlung) in Gegenwart von rotem Phosphor auf Methamphetamin (überlegenes Bild) reduzieren.
Es ist zu sehen, dass ein Ersatz der OH -Gruppe durch das i, gefolgt von einem zweiten Ersatz für ein H.
Verweise
- Wikipedia. (2019). Hydroiodsäure. Abgerufen von: in.Wikipedia.Org
- Andrews, Natalie. (24. April 2017). Die Verwendung von Hydriodsäure. Wissenschaftlich. Erholt von: Scienting.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodsäure. Erholt von: Alfa.com
- Nationales Zentrum für Biotechnologie Information. (2019). Hydriodsäure. Pubchem -Datenbank., CID = 24841. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Steven a. Hardinger. (2017). Illustriertes Glossar der organischen Chemie: Hydroiodsäure. Erholt von: Chem.UCLA.Edu
- Reusch William. (05. Mai 2013). Kohlenhydrate. Geborgen von: 2.Chemie.MSU.Edu
- In Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Reduziertes Traphenoxid durch chemische Graphitisierung. Doi: 10.1038/NCOMMS1067.
- « Memoristische Lerneigenschaften, Typen und Beispiele
- Merkmale, Typen, Vorteile und Stufen von Bioprozessen »

