Säuren und Basenunterschiede, Eigenschaften, Beispiele
- 2001
- 559
- Tizian Liebich
Der Säuren und Basen Es sind chemische Verbindungen, die keine einzige Definition aufweisen, sondern mehrere, die von den Merkmalen oder Eigenschaften abhängen, die berücksichtigt werden. Im Allgemeinen könnte man sagen, dass Säuren saure Substanzen sind, während die Basen Saponáceas oder Seifen sind.
Die wichtigsten Definitionen wie Brönsted-Lowry oder Arrhenius konzentrieren sich mehr auf die Freisetzung von H-Ionen3ENTWEDER+ (Hydronium) u oh-(Hydroxyl) durch diese Substanzen. Entweder in seinen reinen oder gelösten Formen in Wasser.
Eine Definition, die als Folge des oben genannten entsteht, ist Folgendes: Säuren, die in Wasser gelöst wurden. PH ist genau ein Weg, um auszudrücken, wie sauer oder basisch eine Flüssigkeit unter Berücksichtigung der Konzentration von H ist3ENTWEDER+.
Daher haben saure Substanzen wie Orangensaft einen pH -Wert von weniger als 7 und viele H -Ionen3ENTWEDER+. Während die Basen wie Legía einen pH -Wert von mehr als 7 und viele OH -Ionen haben-.
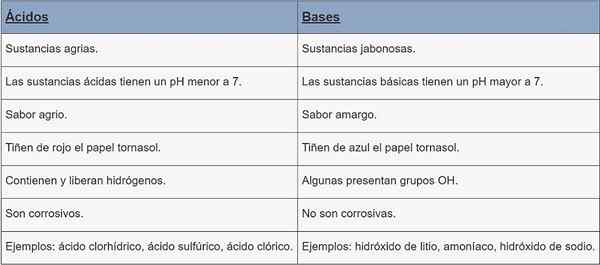
Säuren | Basen | |
Art der Substanz | Agrarsubstanzen. | Jabonesas Substanzen. |
pH | pH weniger als 7. | pH mehr als 7. |
Geschmack | Sauer. | Bitter. |
Färbung | Rotwäschescheide Papier. | Cornstasol Papierfarbe Blau. |
Eigenschaften | Sie enthalten und füllen Hydrogene. | Einige Anwesende OH -Gruppen. |
Korrosion | Sie sind ätzend. | Sie sind nicht ätzend. |
Beispiele | Salzsäure, Schwefelsäure, Chlorsäure. | Lithiumhydroxid, Ammoniak, Natriumhydroxid. |
Säuren
 Orangensaft ist einer der bekanntesten Säurevertreter unseres täglichen Lebens
Orangensaft ist einer der bekanntesten Säurevertreter unseres täglichen Lebens Säureeigenschaften
Säure -Substanzen haben bestimmte Eigenschaften:
Saurer Geschmack
Säuren haben einen sauren Geschmack. Routinemäßig wird eine Art Geschmack mit dem Begriff "Säure" benannt. So wird gesagt, dass der Zitronensaft und die Flüssigkeit einiger Kaugummi Säuren sind, da seine Aromen sauer und stark für den Gaumen sind.
Rotwäschescheide Papier
Säuren sind Substanzen, die die Farbe des Blaues in rotes Spraypapier umwandeln können. Shortasol ist Teil einer Reihe von Substanzen. Diese Substanzen werden als pH -Indikatoren bezeichnet.
Kann Ihnen dienen: koligative Eigenschaften von LösungenSie enthalten und füllen Hydrogene
Die Säuren sind chemische Verbindungen, die das chemische Wasserstoffelement (H) aufweisen, das ihm ihre Säure charakteristisch verleiht.
Viele andere Substanzen enthalten auch Wasserstoff, aber sie können sie nicht freisetzen, wie es mit Säuren passiert. In der Freilassung ist Wasserstoff in Form von Ion oder Cation erfolgt+. Diese h+, Wenn sie die Wassermoleküle treffen, werden sie zu diesen hinzugefügt, um die H -Ionen zu bilden3ENTWEDER+.
Sie transportieren elektrischen Strom
Aufgrund von H -Atomen+ die freigesetzt werden, wenn Säuren in Wasser aufgelöst werden. Diese können Strom durch die Verwendung von Batterien oder Batterien transportieren.
Sie sind ätzend
Es gibt starke Säuren, die sehr ätzend sind. Daher sollte der Kontakt mit ihnen vermieden werden, da sie schwere körperliche Schäden verursachen können. Sogar schwache Säuren bei sehr hohen Konzentrationen wie Essig (Essig) können die Haut und Pharynx verbrennen, wenn ihre Dämpfe atmet.
Stark und schwach
Starke Säuren produzieren eine große Konzentration von H -Ionen3ENTWEDER+ Wenn sie sich im Wasser auflösen. Es wird gesagt, dass die Wasserstoffatome starker Säuren leicht dissoziieren können. Inzwischen füllen schwache Säuren nur wenige Wasserstoffatome frei und erzeugen daher eine niedrigere Konzentration von H -Ionen3ENTWEDER+.
Starke Säuren haben einen sehr niedrigen pH -Wert, der abhängig von der Konzentration und Kraft der Säure 1 oder weniger betragen kann. Stattdessen haben schwache Säuren einen höheren sauren pH -Wert, der beispielsweise 4 oder 5 sein kann.
Starke Säuren haben einen Geruch, der ein brennendes Gefühl erzeugt. In der Zwischenzeit haben schwache Säuren diese Art des Geruchs nicht, selbst in einigen Fällen haben sie angenehme Gerüche. Es gibt jedoch viele Ausnahmen, sodass sie nicht empfohlen werden, auch nur schwache Säuren zu riechen.
Kann Ihnen dienen: Eisenoxid (III): Struktur, Nomenklatur, Eigenschaften, verwendetStarke Säuren sind gute Stromtransporter. Im Gegenteil, schwache Säuren sind schlechte Elektrizitätsleiter, indem sie nur wenige H -Atome freisetzen+.
Starke Säuren können Metalle wie Zink angreifen und eine große Anzahl von Wasserstoffblasen bilden. Diese Reaktion wird nicht durch schwache Säuren erzeugt.
Beispiele für Säuren
Starke Säuren
-HCL: Salzsäure
-H2SW4: Schwefelsäure
-HBR: Bromhydsäure
-Hi: Yodhydriksäure
-Hno3: Salpetersäure
-HCLO4: Perchlorsäure
-HCLO3: Chlorsäure
Schwache Säuren
-CH3COOH: Essigsäure
-Hno2: Salpetersäure
-H2CO3: Kohlensäure
-H3Po4: Phosphorsäure
-C3H5O (COOH): Zitronensäure
-HF: Fluorhydsäure
-H2SW3: Schwefelsäure
Basen
 Das Ammoniak ist eine grundlegende Substanz
Das Ammoniak ist eine grundlegende Substanz Grundmerkmale
Die Basen zeigen die folgenden Eigenschaften:
-Sie produzieren ein viskoses oder Seifenempfinden in den Fingern, wodurch die Objekte von den Händen rutschig werden.
-Sie haben einen bitteren Geschmack.
-Sie können mit Säuren reagieren und die Bildung von Verbindungen produzieren, die als Salze bezeichnet werden. In einigen Fällen können diese ausfällt oder ins Wasser sinken. Auch bei der Reaktion einer Base mit einer Säure wird Wasser gebildet.
-Sie drehen die Farbe des blauen Sprossenpapiers, was darauf hinweist, dass die Lösung einen pH -Wert von mehr als 7 oder alkalisch hat.
-Einige Basen in ihrer chemischen Formel -OH -Gruppen, die Hydroxilli genannt werden und durch ein Wasserstoffatom und ein Sauerstoffatom gebildet werden.
Stark und schwach
Starke Basen sind chemische Verbindungen, die eine oder mehrere OH -Gruppen in ihrer chemischen Struktur vorstellen, die, wenn sie mit Wasser in Kontakt kommen, eine negative Belastung erwerben, OH-.
Inzwischen sind die schwachen Basen nicht in ihren chemischen Formel -Hydroxil -Gruppen vorhanden. Schwache Basen bei der Reaktion mit Wasser erzeugen jedoch auch Ionen oder Anionen OH-.
Starke Basen wie Natriumhydroxid haben sehr hohe pH -Werte nahe 14. Inzwischen haben schwache Basen einen niedrigeren pH -Wert wie Ammoniak, der einen pH -Wert von 11 hat.
Kann Ihnen dienen: Kochen: Konzept, Typen und BeispieleStarke Basen werden in Häusern verwendet, um die Abflüsse aufzudecken. Dies ist der Fall von Kaliumhydroxid. In der Zwischenzeit werden schwache Basen in der Reinigungsarbeit verwendet, wie beispielsweise Ammoniaks, die in vielen Reinigungsmitteln vorhanden sind.
Beispiele für Basen
Starke Grundlagen
-Lioh: Lithiumhydroxid
-NaOH: Natriumhydroxid
-Koh: Kaliumhydroxid
-RBOH: Rubidio Hydroxid
-CSOH: Cäsiumhydroxid
-SR (OH)2: Strontiumhydroxid
-Ba (oh)2: Bariumhydroxid
Schwache Basen
-NH3: Ammoniak
-NHET2: Diethylamin
-NH2CH3: Metilamin
-C5H5N: Pyridin
Unterschiede zwischen Säuren und Basen
Ionen, die veröffentlicht werden
Säuren füllen H -Atome frei+ oder h3ENTWEDER+ Wenn sie sich im Wasser auflösen. In der Zwischenzeit füllen oder produzieren die Basen in Kontakt mit Wasserionen OH-.
PH -Werte
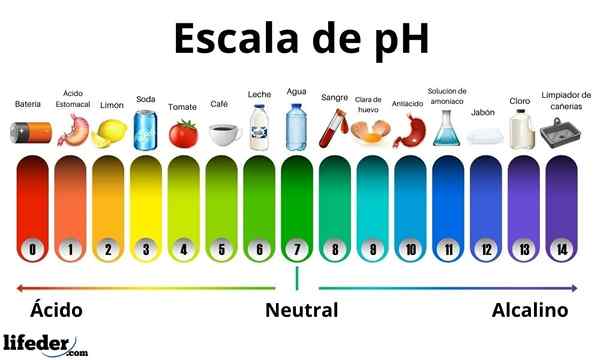
Säuren haben einen pH -Wert zwischen 0 und 7. Inzwischen haben die Basen einen pH -Wert zwischen 7 und 14. Daher drehen Säuren die Farbe des Sprossenpapiers und die Basen drehen sie blau.
Trainingsreaktionen
Säuren stammen aus der Reaktion von nicht -metallischen Elementen Oxiden, zum Beispiel Chlor, Schwefel usw., Mit Wasser oder sie werden auch gebildet, wenn Wasserstoff mit einem nicht -metallischen Element kombiniert wird und dann die gebildete Verbindung in Wasser löst (HF, HCl, HBR usw.).
Die Basen werden durch die Oxidreaktion eines Metalls erzeugt, zum Beispiel Eisen, Kupfer, Magnesium usw., Mit Wasser. Es sollte daran erinnert werden, dass ein Oxid die Kombination von Sauerstoffatomen mit jedem anderen chemischen Element ist.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Helmestine, Anne Marie, ph.D. (11. Februar 2020). Säuredefinition und Beispiel. Erholt von: thoughtco.com
- Science Explorers. (31. Juli 2018). Kinder über Säuren und Basen unterrichten. Erholt von: Sciencexplorern.com
- Entwurf von Exemplap. (2013). Säureeigenschaften. Wiederhergestellt von: beispielhaft.com
- Lumenchemie für Nicht-Majors. (S.F.). Eigenschaften von Säuren und Basen. Erholt von: Kurse.Lumenarning.com
- Clark Jim. (2013). Starke und schwache Stützpunkte. Erholt von: Chemguide.CO.Vereinigtes Königreich
- « Flora und Fauna der repräsentativen Arten von Ecuadorian Sierra
- Methodologischer Rahmen, wie man es, Struktur, Beispiele schreibt »

