Kinetisches Enzym
- 2382
- 625
- Timo Rabenstein
Was ist enzymatische Kinetik?
Der Kinetisches Enzym Es ist ein Studienbereich, in dem sich Physikochemie und Biochemie treffen, um chemische Reaktionen durch Enzyme zu untersuchen. Enzyme sind biologische Katalysatoren, die die Geschwindigkeit einer chemischen Reaktion erhöhen, indem sie ihre Aktivierungsenergie verringern.
Enzyme katalysieren chemische Reaktionen von großer Bedeutung für die Aufrechterhaltung des Lebens. Sie haben sowohl einen pH als auch eine optimale Temperatur, um ihre katalytische Wirkung auf das Substrat auszuüben, sodass sie wesentliche Faktoren für die Untersuchung ihrer Aktivitäten sind.
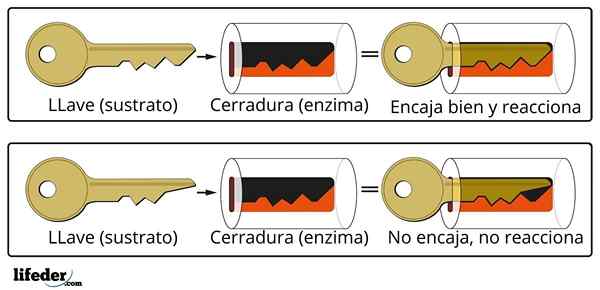
 Das Schlüsselschlüssesystem ist eine ungefähre Analogie zum Substrat-Enzymsystem.
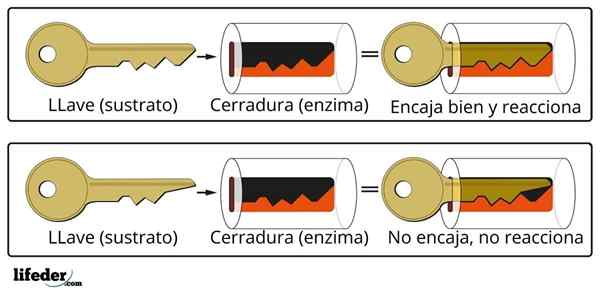
Das Schlüsselschlüssesystem ist eine ungefähre Analogie zum Substrat-Enzymsystem. Das Enzym interagiert mit dem Substrat durch einen spezialisierten Bereich seiner Proteinkette, das als aktives Zentrum bezeichnet wird, dessen dreidimensionale Struktur mit der Substratstruktur gekoppelt ist. Die Wechselwirkung zwischen dem aktiven Zentrum und dem Substrat ist normalerweise schwach und nicht kovalent.
Die Anzahl der aktiven Enzymzentren ist begrenzt und erzeugt ihre Sättigung mit Substratmolekülen, was wiederum verhindert.
Die enzymatische Kinetik kombiniert nicht nur Biochemie und Physikochemie, sondern auch bioinorganische, supramolekulare Chemie, Computerchemie und Statistik.
Unter den Modellen, die es beschreiben, ist die von Michaelis -menc. Heute ist es immer noch eines der Modelle, das die enzymatische Kinetik am meisten beschreibt.
Grundkonzepte in der enzymatischen Kinetik
Enzymatische Katalyse
Enzyme sind Proteine mit katalytischen Aktivitäten, die auf ein Molekül bezeichnet werden können. Enzyme werden während ihrer katalytischen Wirkung nicht konsumiert und bleiben ihre konstante Masse.
Katalytische Aktivität
Die katalytische Aktivität des Enzyms wird in einer spezialisierten dreidimensionalen Struktur durchgeführt, die als aktives Zentrum bekannt ist. Dies wird durch die Falte der enzymatischen Proteinkette gebildet, die die Wechselwirkung einer Gruppe von Aminosäuren bestimmt, die das aktive Zentrum bilden.
Aktives Zentrum
Das aktive Zentrum ist keine starre Struktur, sondern in der Lage, geometrisch an das Substrat anzupassen, um mit ihm zu interagieren. Die Wechselwirkung ist im Allgemeinen schwach (van der Waals Kräfte), obwohl es Enzyme gibt, die eine kovalente Verbindung mit dem Substrat bilden.
Kann Ihnen dienen: Butchrisches Fett: Erhalten, Typen, Zusammensetzung, Verwendungsmöglichkeiten, VorteileVerringerte Aktivierungsenergie
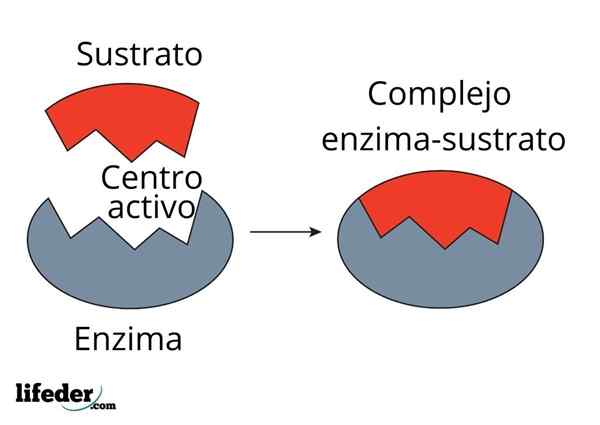
 Carboanhydraseenzym verringert die Aktivierungsenergie für CO2 zu H2CO3 -Umwandlung. Quelle: fvasconcellos (Diskussion • Beiträge), CC BY-SA 3.0, über Wikimedia Commons
Carboanhydraseenzym verringert die Aktivierungsenergie für CO2 zu H2CO3 -Umwandlung. Quelle: fvasconcellos (Diskussion • Beiträge), CC BY-SA 3.0, über Wikimedia Commons Enzyme katalyzieren Reaktionen, die die Aktivierungsenergie verringern und daher auch den Verbrauch der freien Energie (G) verringern, die für den Abschluss des katalysierten Prozesses erforderlich sind. Enzyme modifizieren den Gleichgewichtspunkt nicht katalysierter chemischer Reaktionen nicht.
Beachten Sie, wie das Carboanhydraseenzym die Aktivierungsenergie für die CO -Konversion verringert2 zu h2CO3. Obwohl der Abstand zwischen rot und bläulicher Linie nicht viel zu sein scheint, erhöht dieses Enzym die Geschwindigkeit in der Reihenfolge von Millionen Malen (106)) im Vergleich zur Reaktion ohne Teilnahme.
Stereospezifisch
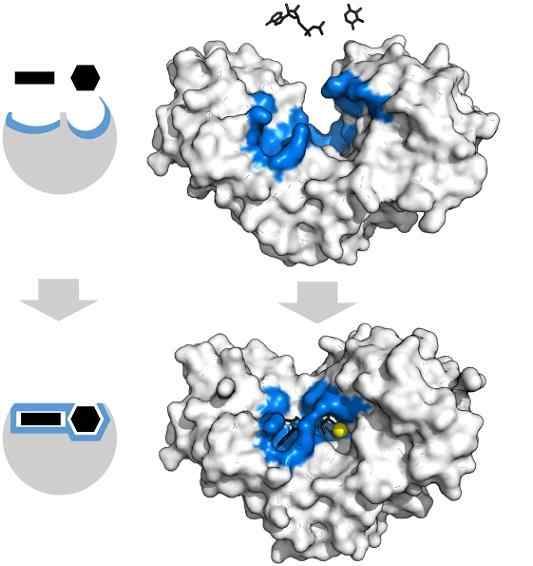 Adenosinsubstrate Tryphosphat und Xylose haben die spezifische Form, die mit der Geometrie des aktiven Zentrums des Hexoquinase -Enzyms zusammenfällt. Quelle: Thomas Shafee, CC von 4.0, über Wikimedia Commons
Adenosinsubstrate Tryphosphat und Xylose haben die spezifische Form, die mit der Geometrie des aktiven Zentrums des Hexoquinase -Enzyms zusammenfällt. Quelle: Thomas Shafee, CC von 4.0, über Wikimedia Commons Enzyme sind im Allgemeinen hochspezifisch für die Reaktionen, die sie katalysieren, da die Substratmoleküle mit dem aktiven Zentrum interagieren müssen, das eine Reihe von Anforderungen für ihre Kopplung darstellt.
So bietet beispielsweise das aktive Zentrum der Hexoquinase, das aufgrund der molekularen Schwingungen von Proteinketten dynamisch ist.
Die geringste physikalische oder chemische Störung und die blaue Region -Hexochinase kann die Substrate nicht mehr aufnehmen.
Maximale Geschwindigkeit
Enzyme haben eine begrenzte Anzahl von aktiven Zentren, daher durch Erhöhen der Substratkonzentration. Dies bestimmt, dass die Geschwindigkeit der katalysierten Reaktion nicht über einen bestimmten Wert hinausgehen kann, der als maximale Geschwindigkeit bezeichnet wird.
Temperaturempfindlichkeit und pH
Die enzymatische katalytische Aktivität hängt von der Temperatur und dem pH -Wert ab und hat optimale Werte dieser Parameter für ihren Betrieb. Ebenso sind sie anfällig für eine chemische oder thermische Denaturierung, da sie die Enzyme -Proteinmoleküle sind.
Cofaktoren
Einige Enzyme erhöhen ihre katalytische Aktivität aufgrund des Einflusses bestimmter Faktoren, die Metalle oder organische Verbindungen sein können, die als Coenzyme bekannt sind.
Ebenso können Enzyme wettbewerbsfähig und nicht entsprechend gehemmt werden. Im Falle der Hexoquinase von oben, der MG2+ (gelbe Kugel) wirkt als Cofaktor.
Enzymatische Reaktionsgeschwindigkeit
Die Geschwindigkeit einer enzymatischen Reaktion hängt von der Konzentration von Substrat und enzymatischer Konzentration ab. Wenn die Substratkonzentration niedrig ist, besteht eine nahezu lineare Beziehung zwischen enzymatischer Geschwindigkeit und Substratkonzentration.
Es kann Ihnen dienen: Keine Metalle: Geschichte, Eigenschaften, Gruppen, VerwendungenDaher nimmt die enzymatische Geschwindigkeit in direktem Anteil zur Substratkonzentration zu; Durch Erhöhen der Substratkonzentration auf einen Wert, der die aktiven Stellen des Enzyms sättigt, wird die maximale Geschwindigkeit erreicht.
Sobald die enzymatische Geschwindigkeit auftritt, wird sie konstant, dh sie ist unabhängig von der Substratkonzentration und es wird gesagt, dass die enzymatische Geschwindigkeit Null ist. Darüber hinaus ist die katalytische enzymatische Geschwindigkeit proportional zur Konzentration des Enzym-Substratkomplexes [IS].
Wie der mathematische Ausdruck zeigt:
V = k2[IST]
Die maximale Geschwindigkeit ist direkt proportional zur Gesamtkonzentration des Enzyms, wie sie in der folgenden Formel erscheint:
VMax = KKatzeUNDT
KKatze Es ist die Rotations- oder Ersatzzahl und repräsentiert die Anzahl der Substratmoleküle, die jede enzymatische Stelle in ein Produkt pro Zeiteinheit umwandelt. WährendT repräsentiert die Anzahl der katalytischen enzymatischen Stellen. JaT Es hat einen hohen Wert, ein höherer [s] ist erforderlich, um die aktiven Stellen oder Zentren zu sättigen.
Michaelis -mente -Gleichung
Modell
Das Modell von Mihaelis -mente basiert auf der Wirkung von Enzymen, die auf ein einfaches Substrat wirken und nicht für die alosterischen Enzyme anwendbar sind. Das heißt, diejenigen, die eine regulatorische Region der katalytischen Aktivität des aktiven Zentrums haben.
Enzyme bei einer geringen Substratkonzentration haben eine katalytische Aktivität, die mit der Substratkonzentration linear ist; Bei hohen Substratkonzentrationen ist die katalytische Aktivität jedoch unabhängig von der Substratkonzentration.
Im Jahr 1913 schlugen Leonor Michelis und Maud ein Modell vor, das angegebene enzymatische Verhalten zu erklären.
Allgemeine Gleichung
Die Beziehung dieses Komplexes zu den anderen Komponenten des enzymatischen Prozesses sowie zu den Konstanten (k), die sie in Beziehung setzen, sind im folgenden Schema angegeben:
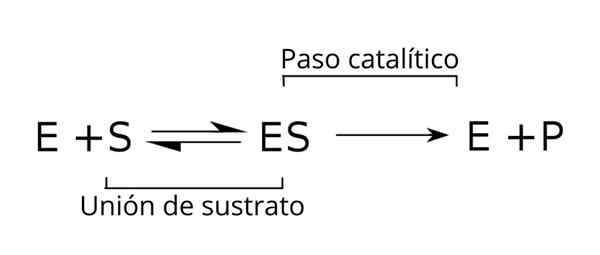 Allgemeine Gleichung der Substrate, des Enzym-Substratkomplexes und der Produkte der enzymatischen Kinetik. Quelle: Tim Vickers über Wikipedia.
Allgemeine Gleichung der Substrate, des Enzym-Substratkomplexes und der Produkte der enzymatischen Kinetik. Quelle: Tim Vickers über Wikipedia. Das Enzym (e) wird mit dem Substrat (s) kombiniert, um den Enzym-Substrat-Komplex mit einer K-Speed-Konstante zu bilden1. Der E-S-Komplex kann in E und S mit einer Reaktionsgeschwindigkeitskonstante k dissoziieren-1.
Ebenso kann der Komplex ein Produkt (P) und die Trennung des Enzyms verursachen, das recycelt werden kann, um einen anderen Zyklus der enzymatischen Aktivität zu erfüllen. Für den Staat ist eine Gleichgewichtssituation erreicht werden.
Es kann Ihnen dienen: natürliche chemische ElementeK1[IS] [s] = (k)-1 + K2) [Ist] (1)
Umzugraben Begriffe und Löschen [IS] haben Sie:
[IS] = ([e] [s]) / (k)-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM Es ist eine von Michaelis eingeführte Konstante.
Bedingungen der Michaelis -Mistree -Gleichung
Jetzt ersetzen kM In (2) Wir fahren fort:
[Ist] = [e] [s] / kM (3)
Die Konzentration des nicht verborgenen Enzyms lautet:
[E] = [eT] - [es] (4)
Wo [e] das freie Enzym und [e) istT] Die Gesamtkonzentration des Enzyms.
Kombination der Gleichungen 3 und 4, die Ersatzstörungen fällig und auch unter Berücksichtigung von VMax, Michaelis-Muene-Gleichung ist erreicht, ausgedrückt auf folgende Weise:
V = (vMax [S]) / ([s] + kM)
Die maximale Geschwindigkeit der enzymatischen Reaktion tritt auf, wenn die Substratkonzentration viel größer als k istM Und die katalytischen Stellen der Enzyme sind mit Substrat gesättigt. Dies geschieht, wenn die Beziehung [s]/[s] + kM Ansätze zu 1.
Wenn [s] gleich K istM, Der Teil der Gleichung [s] / [s] + kM ist gleich 1/2, was darauf hinweist, dass kM Es ist die Konzentration des Substrats, die eine enzymatische Reaktionsgeschwindigkeit erzeugt, die die Hälfte der maximalen Geschwindigkeit beträgt.
Außerdem kM Es ist ein Maß für die Affinität eines Enzyms durch das Substrat: Je größer der Wert des kM, Minor wird die Affinität des Enzyms für das Substrat sein und umgekehrt. Daher zu einem kM Hoch ist die Geschwindigkeit der enzymatischen Reaktion niedrig.
LineWeaver-Burk-Diagramm
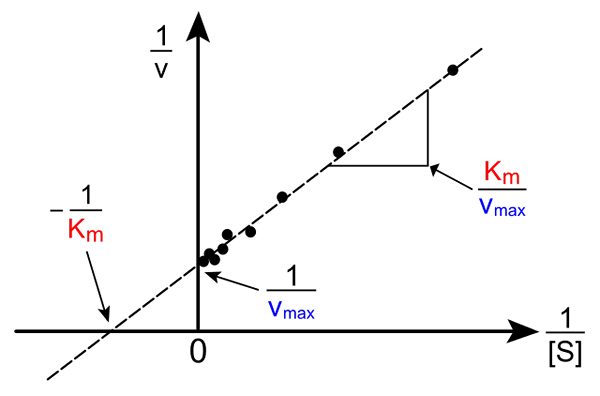 Lineweaver-Burk gerade. Quelle: Pro Bug Catcher über Wikipedia.
Lineweaver-Burk gerade. Quelle: Pro Bug Catcher über Wikipedia. Die Transformation der Michaelis-Muene-Gleichung zur Erzeugung ihrer inversen Form hat die folgende Form:
1/v = (k)M / VMax) (1 / [s]) + 1 / vMax
Die Bedeutung dieser Linie ist, dass sie eine Kreuzung mit der x -Achse in - 1/k hatM, und mit der y -Achse bei y = 1/vMax (oberes Bild). Die Linie hat einen Hang von kM/Vmax. Dies ermöglicht Informationen zu vMax und kM Diagramm der Umkehrung der Geschwindigkeiten in Abhängigkeit von der Umkehrung der Substratkonzentrationen.
Verweise
- Streyer, l. (1975). Biochemie. 2gibt Auflage. Redaktion zurückgekehrt.
- Iran. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe. Mc Graw Hill.
- Wikipedia. (2020). Enzymkinetik. Abgerufen von: in.Wikipedia.Org
- Michael Blaber. (5. Juni 2019). Enzymkinetik. Biology Librettexts. Erholt von: bio.Librettexts.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Michaelis-Muen Kinetik. Erholt von: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biochemie. 5. Ausgabe. New York: W H Freeman; (2002). Sektion 8.4: Das Michaelis-Modell macht die kinetischen Eigenschaften vieler Enzyme aus. Erholt von: NCBI.NLM.NIH.Regierung

