Cysteineigenschaften, Struktur, Funktionen, Biosynthese
- 3048
- 338
- Medine Kedzierski
Der Cystein (Cys, c) ist eine der 22 Aminosäuren, die in der Natur als Teil der Polypeptidketten gefunden werden, aus denen die Proteine der Lebewesen bestehen. Es ist wichtig für die Stabilität der tertiären Strukturen von Proteinen, da es die Bildung von intramolekularen Disulfidbrücken hilft.
Sowie es für andere Aminosäuren wie Alanin, Arginin, Sparagin, Glutamat und Glutamin, Glycin, Prolin, Serin und Tyrosin gilt.
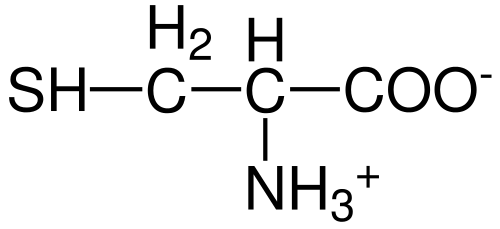
 Cystein Aminosäurestruktur (Quelle: Hattrich [Public Domain] über Wikimedia Commons)
Cystein Aminosäurestruktur (Quelle: Hattrich [Public Domain] über Wikimedia Commons) Trotzdem und angesichts der Tatsache, dass die Syntheseraten nicht immer den Körperanforderungen erfüllen, beschreiben einige Autoren Cystein als "bedingt" im Wesentlichen "Aminosäure".
Diese Aminosäure wurde von der "Cystina" benannt, einer Komponente der vesikulären Berechnungen, die 1810 entdeckt wurden und deren Name 1832 von einem geprägt wurde. Baudrimont und f. Malaguti. Ein paar Jahre später, im Jahr 1884, und. Baumann entdeckte, dass Cystein das Produkt der Cystinreduktion war.
Nach der von Bauman im Jahr 1899 geleisteten Arbeit wurde festgestellt, dass Cystein der Hauptbestandteil des Proteins ist, das die Hörner verschiedener Tiere bildet, was auf die mögliche Verwendung für die Polypeptidsynthese hindeutete.
Gegenwärtig ist bekannt, dass der Körper Cystein aus Lebensmitteln, Proteinrecycling und endogener Synthese stammt, die hauptsächlich in Hepatozyten auftritt.
[TOC]
Eigenschaften
Cystein hat ein Molekulargewicht von 121.16 g/mol und wird zusammen mit Leucin, Isoleucin, Valin, Phenylalanin, Tryptophan, Methionin und Tyrosin zu den hydrophoben Aminosäuren gefunden.
Es gehört zur Gruppe polaren Aminosäuren ohne Ladung und kann wie andere Aminosäuren durch alkalische Hydrolyse bei hohen Temperaturen abgebaut werden.
Wie Tryptophan, Serin, Glycin und Treonin ist Cystein ein metabolischer Vorläufer für die Gluconeogenese und Ketogenese (Bildung von Ketonkörpern).
Diese Aminosäure gibt.
Der Hauptunterschied zwischen freiem Cystein und dem in der Proteinstruktur gefundenen Unterschied besteht darin, dass sich der erste in einem sehr rostigen Redoxzustand befindet, während der letzte normalerweise ziemlich reduziert ist.
Struktur
Wie bei den übrigen bisher beschriebenen Aminosäuren hat das Cystein ein zentrales Kohlenstoffatom, das chiral ist und als Kohlenstoff α bekannt ist.
Vier verschiedene chemische Spezies werden mit diesem Kohlenstoffatom verbunden:
- Eine Amino-Gruppe (-nh3+)
- Eine Carboxylgruppe (-co-)
- ein Wasserstoffatom und
- Ein Substituent (-r).
Die Substituentengruppe ist diejenige, die jeder Aminosäure Identität verleiht, und die des Cysteins ist durch die Enthaltende eines Schwefelatoms als Teil einer Gruppe gekennzeichnet Tiol entweder Sulfhydrillo (-Ch2-sh).

Es ist diese Gruppe, die es ihm ermöglicht, an der Bildung von intra-Termolekularen Disulfidbrücken teilzunehmen. Da es sich um ein Nucleophil handelt, können Sie auch an Substitutionsreaktionen teilnehmen.
Tatsächlich kann diese Seitenkette des Cysteins zur Bildung von zwei als "Selenocystein" und "Lantine" bezeichneten Verbindungen modifiziert werden. Die erste ist eine Aminosäure, die ebenfalls an der Proteinbildung beteiligt ist, und der zweite ist ein Nicht -Protein -Aminosäure -Derivat.
Kann Ihnen dienen: Histone: Eigenschaften, Struktur, Typen und FunktionenDie Cystein Tiol -Gruppe ist auch durch ihre große Affinität zu Silber- und Quecksilberionen gekennzeichnet (Ag+ und Hg2+).
Funktionen
Die Hauptfunktionen von Cystein in lebenden Organismen haben mit ihrer Teilnahme an der Proteinbildung zu tun. Insbesondere nimmt Cystein an der Etablierung von Disulfidbrücken beteiligt, die für die Bildung der tertiären Proteinstruktur essentiell sind.
Darüber hinaus ist diese Aminosäure nicht nur für die Proteinsynthese nützlich, sondern beteiligt sich auch an der Synthese von Glutathion (GSH) und liefert einen verringerten Schwefel für Methionin, Liponsäure, Thiamin, Coenzym A (COA), Molybdopter (ein Cofaktor) und andere Verbindungen mit biologischer Bedeutung.
Unter Bedingungen einer übermäßigen Menge an sulfurisierten Aminosäuren können Cystein und andere verwandte Aminosäuren zur Herstellung von anorganischem Pyruvat und Schwefel verwendet werden. Pyruvat schafft es, in Richtung des gluconeogenen Weges umgeleitet zu werden und für die Glukoseproduktion zu dienen.
Die Keratine, die eine der am häufigsten vorkommenden Arten von Strukturproteinen im Tierreich sind, sind reich an Cysteinresten. Zum Beispiel enthält Schafwolle mehr als 4% Schwefel aus dieser Aminosäure.
Cystein nimmt auch an vielen Oxid-Reduktions-Reaktionen teil, daher ist es Teil des aktiven Zentrums einiger Enzyme.
Bei der Reaktion mit Glukose erzeugt diese Aminosäure Reaktionsprodukte, die attraktiv.
Biosynthese
Die Biosynthese von Aminosäuren im menschlichen Körper und in der von anderen Tieren (Säugetiere und Nicht-Säugetieren) findet in Gewebeform und Zellklasse statt. Es ist ein Prozess, der Energie verdient und normalerweise zwischen verschiedenen Organen getrennt ist.
Die Leber ist eine der wichtigsten Organe, die an der Synthese der meisten nichtwessten Aminosäuren beteiligt sind, unabhängig von den berücksichtigten Spezies.
Darin wird nicht nur das Cystein synthetisiert, sondern auch Aspartat, Asparagin, Glutamat und Glutamin, Glycin, Serin, Tyrosin und andere aus seinen spezifischen Aminosäurevorläufern.
1935 stellte die Marke Erwin fest, dass Cystein bei Säugetieren natürlich aus Methionin synthetisiert wird, das ausschließlich im Lebergewebe stattfindet.
Dieses Verfahren kann aufgrund eines "Transmetils" von Methionin auftreten, bei dem Methylgruppen auf Hügel und Kreatin übertragen werden. Cystein kann jedoch dank einer Tranulfuration auch aus Metionin gebildet werden.
Anschließend wurde gezeigt, dass einige synthetische Verbindungen wie N-Acetylcystein, Cysteamin und Cystamin zusätzlich zu Metionin nützliche Vorläufer für die Cysteinsynthese sind.
Im Fall des N-Acetyl-Cysteins wird dies von den Zellen genommen, wo es durch ein Enzym des Cytosols im Cytosol in Cystein umgewandelt wird.
Synthesemechanismus
Der Mechanismus der Synthese von Cystein aus dem bekanntesten Methode ist der von Trans -ululo. Dies geschieht hauptsächlich in der Leber, wurde aber auch im Darm und in der Bauchspeicheldrüse bestimmt.
Dies geschieht aus Homocystein, einer Verbindung, die aus Aminosäuremethoden stammt; Und die erste Reaktion dieses Biosynthesewegs ist eine Kondensation, die durch das β-Sentase (CBS) Cistationin-Enzym (CBS) katalysiert wird.
Kann Ihnen dienen: Uracil: Struktur, Funktionen, Eigenschaften, SyntheseDieses Enzym repräsentiert den Durchgang des "Engagements" der Route und kondensiert ein Homocystein mit einem Serinrest, einer anderen Proteinaminosäure, die Cystationin produziert. Anschließend wird diese Verbindung durch das Cistationasa -Enzym "geschnitten" oder "geteilt", was zur Freisetzung von Cystein führt.
Die Regulation der enzymatischen CBS -Aktivität wird durch die Verfügbarkeit von Methodin und durch den Redoxzustand der Zelle vermittelt, in dem dieser Prozess auftritt.
Durch die Cysteinsyntheseroute können Zellen überschüssiges Methoden umgehen, da ihre Umwandlung in Cystein ein irreversibler Prozess ist.
Cysteinsynthese in Pflanzen und Mikroorganismen
In diesen Organismen wird das Cystein hauptsächlich aus anorganischem Schwefel synthetisiert, der am häufigsten zu verwendbaren Schwefel in der aeroben Biosphäre die am häufigsten.
Dies wird genommen, in die Zellen eintritt und dann in Sulfid (S2-) reduziert, was in der Synthese von Glutamat oder Glutamin in ähnlicher Weise in das Cystein eingebaut ist wie mit Ammonium.
Stoffwechsel und Verschlechterung
Der Katabolismus -Cystein tritt hauptsächlich in Leberzellen (Hepatozyten) auf, obwohl es auch in anderen Arten von Zellen wie Neuronen, Endothelzellen und glatten Muskelzellen des Körpergefäßatur auftreten kann.
Bestimmte Defekte im Katabolismus des Cysteins produzieren eine erbliche Krankheit.
Das Cystin ist eine Aminosäure, die aus dem Cystein stammt, und die Berechnungen werden durch die Vereinigung von zwei Molekülen durch ihre Schwefelatome gebildet.
Ein Teil des Cystein-Metabolismus führt zur Bildung von wissenschaftlicher Säure, aus der Stierkämpfe eine nicht-protärische Aminosäure gebildet wird. Die Reaktion wird durch das Dioxigenasa -Cystein -Enzym katalysiert.
Darüber hinaus kann das Cystein durch das Formaldehyd oxidiert werden, um N-Formil Cystein zu produzieren, dessen anschließende Verarbeitung zur Bildung von „Waren“ (Produkt der Kondensation von Cysteinen mit aromatischen Verbindungen) führen kann).
Bei Tieren wird auch Cystein sowie Glutamat und Glutamin zur Synthese von Coenzym A, Glutathion (GSH), Pyruvat, Sulfat und Sulfidersäure verwendet.
Eine der Methoden zur Umwandlung von Cystein zu Pyruvat tritt in zwei Schritten auf.
Die Nieren sind für die Ausscheidung von Sulfaten und Sulfiten verantwortlich.
Glutathion
Glutathion, ein Molekül, das aus drei Aminosäurermüll (Glycin, Glutamat und Cystein) gebildet wird, ist ein Molekül, das in Pflanzen, Tieren und Bakterien vorhanden ist.
Es hat spezielle Eigenschaften, die es zu einem hervorragenden Redoxpuffer machen, da es Zellen vor verschiedenen Arten von oxidativem Stress schützt.
Lebensmittel, die reich an Cystein sind
Cystein ist natürlich in Lebensmitteln zu finden.
Es ist auch hauptsächlich in proteinreichen Lebensmitteln wie Fleisch, Hülsenfrüchten und Milchprodukten vorhanden, darunter:
Kann Ihnen dienen: Ovalbumin: Struktur, Funktionen, Denaturierung- Kuhfleisch, Schweinefleisch, Hühnchen und Fisch
- Hafer und Linsen
- Sonnenblumenkerne
- Joghurt und Käse
Vorteile der Cysteinaufnahme
Es wird angenommen, dass seine Aufnahme den Haarausfall verhindert und sein Wachstum stimuliert. In der Lebensmittelindustrie wird es sehr als panifierbares Massagemittel verwendet und auch die fleischähnlichen Aromen „reproduzieren“.
Andere Autoren haben betont, dass die Aufnahme von Nahrungsergänzungsmitteln oder Lebensmitteln abnehmen.
Einige Nahrungsergänzungsmittel im Zusammenhang mit Cystein werden von Menschen als Antioxidantien verwendet, was aus Sicht der "Verzögerung" des Alterns als vorteilhaft angesehen wird.
Das N-Acetyl-Cystein (ein Vorläufer in der Synthese des Cysteins) wird beispielsweise als Nahrungsergänzungsmittel angenommen, da dies zu einer Zunahme der Glutathion-Biosynthese (GSH) führt.
Verwandte Krankheiten
Es gibt einige wissenschaftliche Veröffentlichungen, die ein hohes Plasma -Cystein mit Fettleibigkeit und anderen verwandten Pathologien wie Herz -Kreislauf -Erkrankungen und anderen metabolischen Syndromen beziehen.
Cystinurie ist, wie oben erwähnt.
Mangelerkrankungen
Der Mangel an oxidativem Stress hat sich in Zusammenhang mit einem der Hauptvorläufer für die Glutathion -Synthese zusammenhängt. Mängel in dieser Aminosäure können daher zu vorzeitiger Alterung und allen Wohnungen führen, die dies bedeutet.
Es wurde experimentell gezeigt, dass die Cystein -Supplementierung die Funktionen des Skelettmuskels verbessert, die Beziehung zwischen Fett- und Fett -Körpermasse verringert, die Plasmaspiegel entzündlicher Zytokine verringert, die Funktionen des Immunsystems usw. verbessert usw.
In den Mitte der 1990er Jahre deuten einige Studien darauf hin, dass das erworbene Immunschwäche (AIDS) -Syndrom eine Folge eines von Virus induzierten Cysteinmangels sein könnte.
Diese Aussagen wurden durch die Tatsache gestützt, dass die untersuchten Hi-positiven Patienten einen geringen Plasma-Cystin- und Cysteinspiegel sowie eine verringerte intrazelluläre Konzentrationen von Glutathion aufwiesen.
Verweise
- Dröge, w. (1993). Cystein und Glutathiondefizion bei AIDS-Patienten: eine Begründung für die Behandlung mit N-Aceeicyl-Cystein. Pharmakologie, 46, 61-65.
- Dröge, w. (2005). Oxidativer Stress und Alterung: Altert ein Cystein -Defizivie -Syndrom? Philosophische Transaktionen der Royal Society B: Biological Sciences, 360(1464), 2355-2372.
- Elshorbagy, a. K., Smith, a. D., Kozich, v., & Refsum, h. (2011). Cystein und Fettleibigkeit. Fettleibigkeit, zwanzig(3), 1-9.
- Kridich, n. (2013). Biosynthese von Cystein. EcoSous Plus, 1-30.
- McPherson, r. ZU., & Hardy, g. (2011). Klinische und Ernährungsvorteile von mit Cystein angereicherten Proteinpräparaten. Aktuelle Meinung in der klinischen Ernährung und Stoffwechselversorgung, 14, 562-568.
- Mokhtari, v., Afsharian, p., Shahhoseeini, m., Kalantar, s. M., & Moini, a. (2017). Eine Übersicht über verschiedene Verwendungen von N-Acetyl-Cystein. Cell Journal, 19(1), 11-17.
- Piste, p. (2013). Cystein-Master-Antioxidans. Internationales Journal of Pharmaceutical, Chemical and Biological Sciences, 3(1), 143-149.
- Quig, d. (1998). Cysteinstoffwechsel und Metalltoxizität. Alternative Medicine Review, 3(4), 262-270.
- Wu, g. (2013). Aminosäuren. Biochemie und Ernährung. Boca Raton, FL: Taylor & Francis Group.
- « Merkmale des sozialen Lernens, Bandura -Theorie, Beispiele
- Socio -emotionale Bildungsdimensionen, Wichtigkeit, Vorschule »

